
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
分析 A.液态水为稳定氧化物;
B.由吸热反应可知,石墨的能量低;
C.完全燃烧均生成气体二氧化硫,但硫的蒸气能量比硫固体能量高;
D.化学能可转化为热能、光能等,主要为热量变化.
解答 解:A.燃烧热是指在一定压强下,1 mol的可燃物完全燃烧生成稳定的氧化物的时候所放出的热量,而这个反应中的水是气态,故A错误;
B.石墨转化成金刚石为吸热反应,故金刚石的能量高,不稳定,故B错误;
C.等质量时,气态硫的能量比固态硫的高,所以完全燃烧时,气态物质放出的热量多,故C错误;
D.化学能可转化为热能、光能等,反应中的能量变化,通常表现为热量的变化,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、物质稳定性比较、燃烧热判断为解答的关键,侧重分析与应用能力的考查,注意燃烧热概念的要点,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
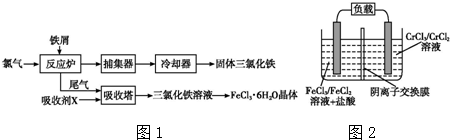
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
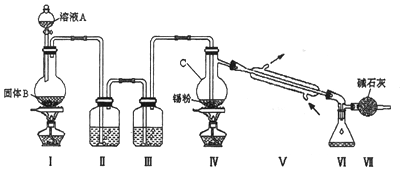
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com