
| A. | 浓硝酸应保存在棕色试剂瓶并置于阴凉处 | |
| B. | 氢氟酸不能装在玻璃瓶,应装在塑料瓶中 | |
| C. | NaOH溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 常温下浓硫酸和浓硝酸可以铁制槽罐车运输 |
分析 A.浓硝酸见光易分解;
B.氢氟酸能与玻璃反应生成四氟化硅气体;
C.硅酸钠能黏合玻璃;
D.金属钝化的实质是金属被浓硫酸、浓硝酸氧化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸、浓硝酸.
解答 解:A.浓硝酸见光易分解,应放在棕色试剂瓶中避光保存,故A正确;
B.氢氟酸能与玻璃反应生成四氟化硅气体,应保存在塑料瓶中,故B正确;
C.NaOH溶液能与二氧化硅反应生成硅酸钠,硅酸钠能黏合玻璃,导致玻璃塞打不开,应用橡皮塞,故C错误;
D.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铁制槽罐车运输浓硫酸、浓硝酸,故D正确.
故选C.
点评 本题考查较为综合,涉及药瓶的保存,侧重于学生的分析能力和实验能力的考查,为高频考点,注意药品的保存取决于物质的性质,学习中注意相关基础知识的积累,难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
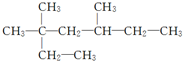 的命名正确的是( )
的命名正确的是( )| A. | 2,4-二甲基-2-乙基己烷 | B. | 3,5,5-三甲基庚烷 | ||
| C. | 3,3-二甲基-5-甲基庚烷 | D. | 3,3,5-三甲基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
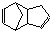 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.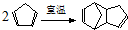 ,反应类型为加成反应;
,反应类型为加成反应;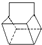 )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com