
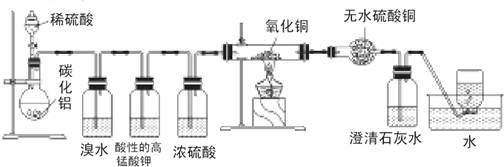
分析 (1)根据碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷可知碳化铝与硫酸反应生成硫酸铝和甲烷;
(2)根据实验甲的实验目的和甲烷的性质进行解答,若集气瓶中收集到的气体属于有毒气体,则不能排放到空气中,反之能;
(3)A.若甲烷能与强氧化剂反应,酸性高锰酸钾溶液褪色;
B.硬质试管里黑色粉末无颜色变化,可能为铜、氧化铜或氧化亚铜的混合物;
C.氧化铜与甲烷反应生成水和二氧化碳、一氧化碳,硬质试管里黑色粉末也能变红色;
D.甲烷能与卤素单质发生取代反应;
(4)甲烷与氧化铜反应,碳元素化合价升高,铜元素化合价降低结合甲烷与氧化铜物质的量之比2:7书写.
解答 解:(1)碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,碳化铝与硫酸反应可理解为碳化铝(Al4C3)与水反应,产物再和硫酸反应,所以产物为硫酸铝和甲烷,反应方程式为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,
故答案为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑;
(2)碳化铝与硫酸反应生成硫酸铝和甲烷,甲方案探究甲烷与氧化剂反应,盛放浓硫酸的装置放置在氧化剂氧化铜之前,所以实验甲中浓硫酸的作用是干燥CH4,甲烷和氧化铜反应,碳元素化合价升高,生成碳的氧化物,产物中可能有一氧化碳生成,所以集气瓶中收集到的气体不能直接排放到空气中,
故答案为:干燥CH4;不能;
(3)A.甲烷不能与强氧化剂反应,若能反应,则酸性高锰酸钾溶液在甲烷的作用下会褪色,现不褪色,结论是通常条件下,甲烷不能与强氧化剂反应,故A正确;
B.甲烷能与氧化铜反应,当少量甲烷参加反应,硬质试管里为大量黑色粉末氧化铜和少量铜的混合物,业可能为氧化亚铜,现象无颜色变化,结论是甲烷不与氧化铜反应时错误的,故B错误;
C.氧化铜与甲烷反应生成水和二氧化碳、一氧化碳,硬质试管里黑色粉末也能变红色,故C错误;
D.甲烷不能与溴水反应,但甲烷能与卤素单质发生取代反应,故D错误;
故选A;
(4)甲烷中碳元素化合价为-4价,甲烷与氧化铜反应,碳元素化合价升高,甲烷与氧化铜物质的量之比2:7,先根据氢守恒确定水前系数,再根据碳、氧守恒得硬质试管里可能发生的化学方程式为:2CH4+7CuO$\frac{\underline{\;\;△\;\;}}{\;}$7Cu+CO+CO2+4H2O,
故答案为:2CH4+7CuO$\frac{\underline{\;\;△\;\;}}{\;}$7Cu+CO+CO2+4H2O.
点评 本题是关于甲烷的还原性的实验探究,考查了元素守恒定律的运用及实验的步骤、物质的性质等,掌握实验室制取氯气的反应原理,明确甲烷的取代反应原理、反应条件是解答关键,试题培养了学生灵活应用所学知识的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酒精浓度越高消毒效果愈好 | |
| B. | 涤纶、塑料、光导纤维都是有机高分子材料 | |
| C. | 用电镀厂的废水直接灌溉农田,可提高水的利用率 | |
| D. | 外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 | |
| 分类标准 | 金属氧化物 | 金属单质 | ||
| 不属于该类别的物质 | Cu | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:
有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与足量CO2反应后转移的电子数为NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2 NA | |
| C. | 常温常压下,11.2 L CH4中含有的氢原子数为2 NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据钠和镁分别与冷水的反应情况,判断钠和镁金属性的强弱 | |
| B. | 根据氯水与溴化钠溶液的反应情况,判断氯和溴非金属性的强弱 | |
| C. | 根据HF和HCl的水溶液的酸性强弱,判断氟与氯非金属的强弱 | |
| D. | 根据Na+和K+的氧化性的强弱,判断钠和钾的金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com