
【题目】在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g),采用下列措施不能改变反应速率的是
A. 加热 B. 保持容器体积不变,增加通入H2的量
C. 充入N2,保持容器内压强不变 D. 充入N2,保持容器内体积不变
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. K+、Mg2+、SO42﹣、OH- B. Fe2+、Cl﹣、H+、NO3﹣
C. Na+、K+、CO32﹣、Cl﹣ D. Fe3+、SCN-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg﹣H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( ) 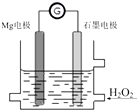
A.石墨电极是该电池的正极
B.石墨电极上发生还原反应
C.Mg电极的电极反应式:Mg﹣2e﹣=Mg2+
D.电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加工橘子罐头,采用酸碱处理脱去中果皮(橘络),会产生严重污染。目前使用酶解法去除橘络,可减少污染。下列生长在特定环境中的4类微生物,不能大量产生所用酶的有( )
A. 生长在麦麸上的黑曲霉 B. 生长在酸奶中的乳酸菌
C. 生长在棉籽壳上的平菇 D. 生长在木屑上的木霉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子核外电子能量最高的电子亚层是________;H、C、N、O、Na的原子半径从小到大的顺序为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: 
(1)A在元素周期表中的位置 .
B的最高价氧化物化学式为 .
写出C元素气态氢化物的电子式 .
(2)D的单质与水反应的化学方程式为 .
(3)五种元素中原子半径最小的是(填元素符号),这些元素的最高价氧化物的对应水化物中酸性最强.
(4)C的一种氧化物是常见的大气污染物.为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO42H2O).假设在转化过程中C元素不损失,每天处理1120m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
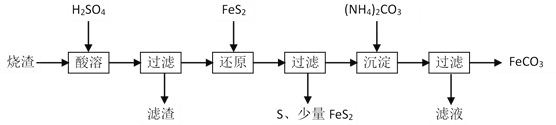
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
下列说法不正确的是
A. “还原”后可以用KSCN检验Fe3+是否反应完全
B. “还原”时反应Ⅱ的离子方程式为2Fe3+ + FeS2 = 2S↓+ 3Fe2+
C. “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3
D. 所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应焓变是指1 g物质参加反应时的能量变化
B. 当反应放热时,△H>0,反应吸热时,△H<0
C. 在加热条件下发生的反应均为吸热反应
D. 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H为“﹣”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com