
| A、H3和H2互为氢元素的两种核素 |
| B、H3是氢元素的一种同位素 |
| C、相同体积的H3和H2气体所含分子数比为1:1 |
| D、H3的摩尔质量是3 g?mol-1 |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
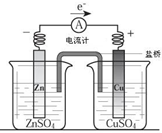
| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
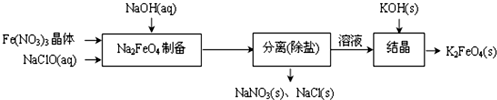
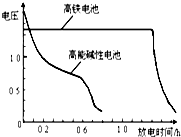
查看答案和解析>>
科目:高中化学 来源: 题型:
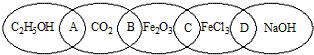
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
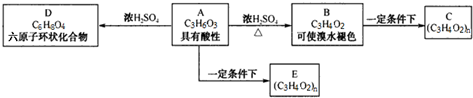
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com