
关于如图所示①、②两个装置的评价正确的是
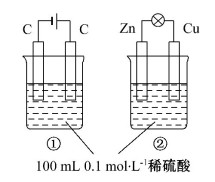
选择 | 叙 述 | 评价 |
A | 装置名称:①电解池,②原电池 | 错误 |
B | 硫酸浓度变化:①增大,②减小 | 错误 |
C | 电极反应式:①阳极:4OH--4e-====2H2O+O2↑ ②正极:Zn-2e-====Zn2+ | 正确 |
D | 离子移动方向:①H+向阴极移动 ②H+向正极移动 | 正确 |
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
葡萄糖不能发生的反应有( )
A.酯化反应 B.银镜反应 C. 还原反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
A.①③④ B.②④⑧ C.①③⑤ D.①⑤⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:选择题
下列现象或事实可用同一原理解释的是
A氯化铵晶体和碘晶体加热都产生气体
B.明矾和液氯都可用于处理生活用水
C.漂白粉和过氧化钠都可用于漂白有色织
D.常温下,铁和铜分别放在浓硫酸中都无明显现象
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)
已知CO(g)+H2O(g)  CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003 mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质:
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1
 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1
 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1
 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1
请写出 与
与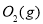 反应生成
反应生成 热化学方程式 。
热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:填空题
(14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1 |
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
C原子核外所有p轨道全满或半满 |
D元素的主族序数与周期数的差为4 |
E是前四周期中电负性最小的元素 |
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)某同学根据上述信息,所画的B电子排布图如图 ,违背了 原理。
,违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。

查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列推断正确的是 ( )
A.BF3是三角锥形分子
B.NH 的电子式:
的电子式: ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的s?p σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3 σ键
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
A.1 B.3C.4 D.6
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:填空题
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
化学键 | Si-Si | O=O | Si-O |
键能/kJ·mol-1 | a | b | c |
写出硅高温燃烧的热化学方程式 。
Ⅱ.利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。写出下列电解池中总反应的离子方程式:

电解池A 。
电解池B 。
(2)若电解池A中生成3.36 L H2(标准状况),计算电解池B中生成Fe2+的物质的量为 mol。
Ⅲ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g) 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。

请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
①a=1,c=2,则b= 。在此情况下,反应起始时将向 反应方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
(2)在上述恒压装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com