
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 滴定操作时,滴定管必须使用待装液润洗,锥形瓶不能润洗;滴定时眼睛应该注视锥形瓶中混合液颜色变化;滴定终点现象为溶液由无色变成粉红色且半分钟不褪色;滴定管读数应该读到0.01mL.
解答 解:c加入待测的NaOH溶液,碱式滴定管用蒸馏水洗完,必须使用待装液润洗,才能量取氢氧化钠溶液,故c错误;
j.边注视滴定管内液面变化,该操作错误,滴定时眼睛应该注视锥形瓶中溶液颜色变化,以便及时判断达到终点,故j错误;
k.当小心滴到溶液由无色变成粉红色且半分钟不褪色时,才能停止滴定,否则提前结束滴定,影响滴定结果,故k错误;
m.滴定管准确度为0.01mL,滴定管的两次读数得出NaOH溶液的体积应该为22.00mL,故m错误;
根据分析可知,错误的有4处,
故选C.
点评 本题考查化学实验方案的评价,主要考查中和滴定的操作、仪器、误差分析,题目难度不大,注意实验的基本操作方法及其规范性和注意事项,如:滴定时眼睛注视锥形瓶内液体颜色变化而不是滴定管内液面变化,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基所含有的电子数是NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 17g羟基所含有的电子数是10NA | |
| D. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
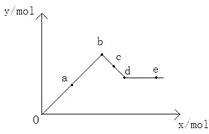
| A. | a-b时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | c-d时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol/LNa2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的①CH3 COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com