
| 元素代号 | L | M | Q | R | T |
| 原子半径 | 0.160 nm | 0.143 nm | 0.112 nm | 0.104 nm | 0.066 nm |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
| A.将Cl2通入紫色石蕊试液,溶液先变红后褪色 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体 |
| D.常温下,可以用铁质容器储运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、Y、Z三种元素不能组成一种盐 |
| B.X单质与Z单质直接反应可生成两种化合物 |
| C.X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质 |
| D.X、Y形成的一种离子跟H+反应可生成Y的离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
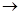 丁+己,甲+丙
丁+己,甲+丙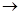 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是| A.元素X在周期表中的位置为第2周期ⅥA族 |
| B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素原子的多样性是由构成原子的质子和中子数目引起的 |
| B.元素的化学性质主要取决于元素原子的最外层电子数 |
| C.只由一种分子构成的物质一定是纯净物 |
| D.质子数等于电子数的微粒,可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
| C.稀有气体元素原子的最外层电子数均为8 |
| D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com