
·ÖĪö ĆæøöĢ¼Ō×ÓÓŠ4øö¼Ū¼ü£¬¶ŌÓŚĢžCxHy·Ö×Ó£¬³żĮĖĒāŌ×ÓÖ®Ķā¾ĶŹĒĢ¼ÓėĢ¼Ö®¼äµÄ¹²ÓƵē×Ó¶Ō£¬ÓÉÓŚĆæĮ½øöĢ¼¹²ÓĆÕāŠ©µē×Ó¶Ō£¬Ņņ“ĖĢ¼ÓėĢ¼Ö®¼äµÄ¹²ÓƵē×Ó¶ŌŹżĪŖ£ŗ$\frac{4x-y}{2}$£¬ĄūÓĆ“Ė¹«Ź½“śČė¼“æÉĒó½ā¼“æÉ£®
½ā“š ½ā£ŗĆæøöĢ¼Ō×ÓÓŠ4øö¼Ū¼ü£¬¶ŌÓŚĢžCxHy·Ö×Ó£¬³żĮĖĒāŌ×ÓÖ®Ķā¾ĶŹĒĢ¼ÓėĢ¼Ö®¼äµÄ¹²ÓƵē×Ó¶Ō£¬ÓÉÓŚĆæĮ½øöĢ¼¹²ÓĆÕāŠ©µē×Ó¶Ō£¬Ņņ“ĖĢ¼ÓėĢ¼Ö®¼äµÄ¹²ÓƵē×Ó¶ŌŹżĪŖ£ŗ$\frac{4x-y}{2}$£¬
£Ø1£©·Ö×ÓŹ½ĪŖCnH2n+2µÄĢž·Ö×ÓÖŠĢ¼Ģ¼¼ä¹²ÓƵē×Ó¶ŌŹżĪŖ£ŗ$\frac{4x-y}{2}$=$\frac{4n-£Ø2n+2£©}{2}$=n-1£¬
¹Ź“š°øĪŖ£ŗn-1£»
£Ø2£©·Ö×ÓŹ½ĪŖCnH2n-6µÄĢž·Ö×ÓÖŠĢ¼Ģ¼¼ä¹²ÓƵē×Ó¶ŌŹżĪŖ£ŗ$\frac{4x-y}{2}$=$\frac{4n-£Ø2n-6£©}{2}$=n+3£¬
¹Ź“š°øĪŖ£ŗn+3£»
£Ø3£©ČōijĪļÖŹ·Ö×ÓÖŠĢ¼Ģ¼¼ä¹²ÓƵē×Ó¶ŌŹżĪŖ160£¬ŌņCxĻąµ±ÓŚCxHy·Ö×ÓÖŠy=0£¬Ōņ£ŗ$\frac{4x}{2}$=160£¬½āµĆ£ŗx=80£¬CxµÄ·Ö×ÓŹ½ĪŖC80£¬
¹Ź“š°øĪŖ£ŗC80£»
£Ø4£©µ„Ļ©ĢžµÄĶØŹ½ĪŖ£ŗCnH2n£¬ŌņøƵ„Ļ©Ģž·Ö×ÓÖŠĢ¼Ģ¼¼ä¹²ÓƵē×Ó¶ŌŹżĪŖ£ŗ$\frac{4x-y}{2}$=$\frac{4n-2n}{2}$=80£¬½āµĆ£ŗn=80£¬øƵ„Ļ©ĢžµÄ·Ö×ÓŹ½ĪŖ£ŗC80H160£¬
¹Ź“š°øĪŖ£ŗC80H160£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓŠ»śĪļ·Ö×ÓŹ½µÄČ·¶Ø£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·ĢžCxHy·Ö×ÓÖŠĢ¼ÓėĢ¼Ö®¼äµÄ¹²ÓƵē×Ó¶ŌŹżĪŖ$\frac{4x-y}{2}$ĪŖ½ā“š¹Ų¼ü£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪö”¢¹éÄÉÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | äåŅŅĶéŗĶĖ®µÄ»ģŗĻĪļ²ÉÓĆ·ÖŅŗµÄ·½·Ø·ÖĄė | |
| B£® | äåŅŅĶéÖŠµĪČėAgNO3ČÜŅŗ¼ģŃéĘäÖŠµÄäåŌŖĖŲ£ŗBr-+Ag+ØTAgBr”ż | |
| C£® | Č”ÕįĢĒŌŚĻ”ĮņĖį×÷ÓĆĻĀµÄĖ®½āŅŗÓŚŅ»½ą¾»µÄŹŌ¹ÜÖŠ£¬¼ÓČėŅų°±ČÜŅŗ£¬Ė®Ō”¼ÓČČ¼“æÉÉś³ÉŅų¾µ | |
| D£® | ÖĘŅŅČ²Ź±£¬½«±„ŗĶŹ³ŃĪĖ®øÄĪŖĖ®ŅŌµĆµ½Ę½ĪȵÄŅŅČ²ĘųĮ÷ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½µÄĆܶȓóÓŚĖ® | |
| B£® | ±½ÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌ±½ŹōÓŚĻ©Ģž | |
| C£® | ±½·Ö×ÓÖŠ6øöĢ¼Ģ¼¼üĶźČ«ĻąĶ¬ | |
| D£® | ±½æÉŅŌÓėäåĖ®”¢øßĆĢĖį¼ŲČÜŅŗ·“Ó¦¶ųŹ¹ĖüĆĒĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼×±½”¢¶ž¼×±½¶¼ŹōÓŚ±½µÄĶ¬ĻµĪļ£¬ŅĄ¾ŻŹĒÕāĮ½ÖÖĪļÖŹ·Ö×ÓÖŠ¾łŗ¬ÓŠ¼×»ł | |
| B£® | “¼ĄąµÄ¹ŁÄÜĶÅŹĒøśĢž·Ö×ÓÖŠ±„ŗĶĢ¼Ō×ÓÖ±½ÓĻąĮ¬µÄōĒ»ł | |
| C£® | “¼ĄąŗĶ·ÓĄą¾ßÓŠĻąĶ¬µÄ¹ŁÄÜĶÅ£¬Ņņ¶ų¾ßÓŠĻąĶ¬µÄ»ÆѧŠŌÖŹ | |
| D£® | ¼×“¼”¢ŅŅ¶ž“¼”¢øŹÓĶ¶¼ŹōÓŚ“¼£¬ŅĄ¾ŻŹĒÕāČżÖÖĪļÖŹ·Ö×ÓÖŠ¾łŗ¬ÓŠ±„ŗĶĢž»ł |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1ÖÖ | B£® | 2ÖÖ | C£® | 3ÖÖ | D£® | 4ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·Ö×ÓŹ½ĪŖC4H8µÄĻ©ĢžÓŠ4ÖÖĶ¬·ÖŅģ¹¹Ģ壬ĖüĆĒµÄČŪµć”¢·Šµćø÷²»ĻąĶ¬ | |
| B£® | ŅŅĻ©”¢±½·Ó”¢ŅŅČ©¾łÄÜÓėäåĖ®·“Ó¦£¬Ęä·“Ó¦ŌĄķø÷²»ĻąĶ¬ | |
| C£® | µ¼µēøß·Ö×Ó²ÄĮĻPPV£ŗ ŗĶ¾Ū±½ŅŅĻ©¾ßÓŠĻąĶ¬µÄÖŲø“½į¹¹µ„ŌŖ ŗĶ¾Ū±½ŅŅĻ©¾ßÓŠĻąĶ¬µÄÖŲø“½į¹¹µ„ŌŖ | |
| D£® | ŅŌµķ·ŪĪŖ»ł±¾ŌĮĻæÉÖĘČ”ŅŅĖįŅŅõ„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
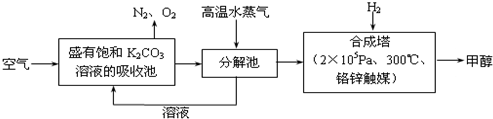
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 28gŅŅĻ©Óė30gŅŅĶéÖŠŗ¬ÓŠµÄ¼«ŠŌ¹²¼Ū¼üøöŹżÖ®±Č2£ŗ3 | |
| B£® | ³£ĪĀ”¢³£Ń¹ĻĀ£¬22.4L C2H4ĘųĢåĶźČ«¼Ó³ÉŠčŅŖlmolBr2 | |
| C£® | C2H6ŗĶC4H10²»Ņ»¶ØŹĒĶ¬ĻµĪļ | |
| D£® | 1molH2O2ĶźČ«·Ö½āŹ±×ŖŅʵē×Ó2NAøö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1.0mol/L µÄNa2CO3ČÜŅŗÖŠ£ŗc£ØH+£©+c£ØNa+£©=c£ØHCO3-£©+c£ØCO32-£©+c£ØOH-£© | |
| B£® | 1.0mol/LNH4ClČÜŅŗ£ŗc£ØNH4+£©=c£ØCl-£© | |
| C£® | Ļņ“×ĖįÄĘČÜŅŗÖŠ¼ÓČėŹŹĮæ“×Ėį£¬µĆµ½µÄĖįŠŌ»ģŗĻČÜŅŗ£ŗc£ØNa+£©£¾c£ØCH3COO-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| D£® | ĻņĻõĖįÄĘČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖįµĆµ½µÄpH=5µÄ»ģŗĻČÜŅŗ£ŗc£ØNa+£©=c£ØNO3-£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com