
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
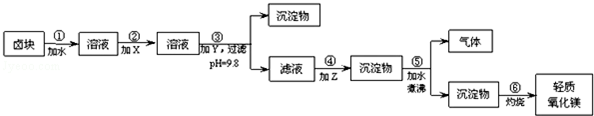
分析 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子,所以卤块水溶液中含有Mg2+、Fe3+、Fe2+和Mn2+等离子,为除去Fe2+,先将Fe2+氧化成Fe3+,则进入的X应该具有氧化性且价格较低廉,为NaClO;然后加入NaOH调节pH为9.8,则Y为NaOH;然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,则Z为纯碱;
(1)实验室用KSCN溶液检验Fe3+;
(2)X能氧化亚铁离子生成铁离子,则X应该具有氧化性且价格低廉;
(3)Y能调节溶液的pH值,煮沸碳酸镁溶液得到氢氧化镁沉淀和二氧化碳,发生沉淀的转化;
(4)用于灼烧固体的仪器是坩埚;
(5)pH=4.0,c(H+)=0.0001mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38,c(Fe3+)×c3(OH-)=4.0×10-38,据此计算c(Fe3+).
解答 解:卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子,所以卤块水溶液中含有Mg2+、Fe3+、Fe2+和Mn2+等离子,为除去Fe2+,先将Fe2+氧化成Fe3+,则进入的X应该具有氧化性且价格较低廉,为NaClO;然后加入NaOH调节pH为9.8,则Y为NaOH;然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,则Z为纯碱;
(1)KSCN与Fe3+作用使溶液显红色,证明某溶液中是否含有Fe3+,可以向溶液中加入硫氰化钾溶液,若溶液变成红色,证明溶液中含有铁离子,否则不含铁离子,
所以实验操作为:取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子,
故答案为:取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子;
(2)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故X为漂液;
故答案为:漂液(NaClO);
(3)加入Y的目的是调节pH,选用氢氧化钠,故Y为烧碱;加入的Z物质为纯碱,所以步骤④生成的沉淀物是MgCO3,所以步骤⑤中沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2和CO2气体,反应的化学方程式为:MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑,
故答案为:烧碱(NaOH); MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑;
(4)步骤⑥由氢氧化镁灼烧制备氧化镁,应该在耐高温的坩埚中进行,
故答案为:坩埚;
(5)pH=4.0,c(H+)=0.0001mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38,c(Fe3+)×c3(OH-)=4.0×10-38,c(Fe3+)=4×10-8mol/L,
故答案为:4×10-8mol/L.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合运用能力及计算能力,涉及仪器选取、沉淀转化、溶度积计算、离子检验等知识点,明确物质性质、化学反应原理等知识点是解本题关键,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压缩容器体积,增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
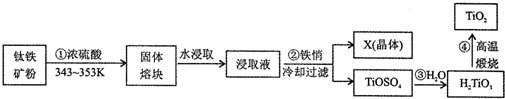
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
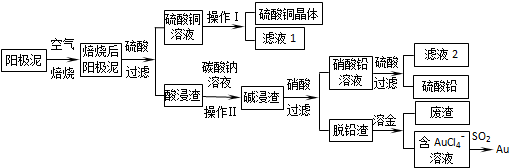
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应原理 | 实验装置 | 实验步骤 |
(1)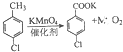 (2) 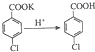 | 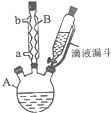 | ①在规格为250mL的仪器A中加入一定量的催化剂(易溶于有机溶剂)、适量KMnO4、100mL水; ②安装好仪器,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯; ③控制温度在93℃左右,反应2h,趁热过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却; ④再次过滤,将滤渣用冷水进行洗涤,干燥后称得其质量为7.19g |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 属于可溶性盐 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
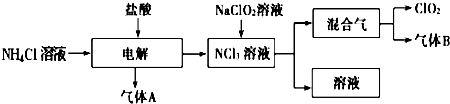
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com