
| A、C3H4 |
| B、C2H6 |
| C、C2H6O |
| D、C2H4O2 |
| y-2z |
| 4 |
| y-2z |
| 4 |
| y-2z |
| 4 |
| y-2z |
| 4 |
| 4-0 |
| 4 |
| 6-0 |
| 4 |
| 6-2×1 |
| 4 |
| 4-2×2 |
| 4 |


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、H3BO3的酸性与H2CO3的酸性 |
| B、向Ag2CrO4浑浊液中加NaCl溶液,有AgCl沉淀生成,那么Ksp (Ag2CrO4) 与Ksp(AgCl) |
| C、I2在KI溶液中和在水中的溶解度 |
| D、相同温度下,l0ml 0.lmol?L一醋酸与100ml 0.01mol?L一醋酸中的H+物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
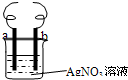 用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )
用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )| A、构成原电池时b极反应为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少 |
| D、构成的原电池或电解池工作后都会产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、8种 |
| C、12种 | D、16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol羟基(-OH)含有10NA个电子 |
| B、在18gH218O中含有10NA个中子 |
| C、标准状况下,22.4L四氯化碳含有NA个四氯化碳分子 |
| D、室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com