
| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
分析 X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W同主族,且可形成原子个数比为2:l、3:1的两种常见物质,则X为O、W为S元素;Y、Z是金属元素,Y的单质能与水剧烈反应,则Y为Na元素;Z可形成含氧酸根离子,则Z为Al元素,据此结合元素周期律知识进行解答.
解答 解:X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W同主族,且可形成原子个数比为2:l、3:1的两种常见物质,则X为O、W为S元素;Y、Z是金属元素,Y的单质能与水剧烈反应,则Y为Na元素;Z可形成含氧酸根离子,则Z为Al元素,
A.Y为Na、Z为Al,金属钠与溶液中水反应,不会在溶液中置换出Al,故A错误;
B.非金属性O>S,则最简单氢化物的稳定性:X>W,故B错误;
C.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径大小为:W>X>Y>Z,故C正确;
D.X为O,Y为Na,Z为Al,O与Na形成的化合物过氧化钠中含有共价键和离子键,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意掌握离子半径、氢化物稳定性的方法,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
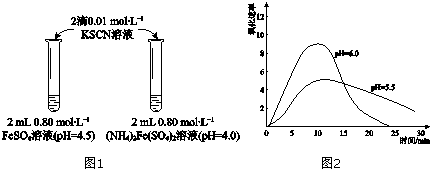
| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
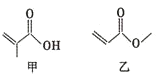
| A. | 甲、乙互为同分异构体 | |
| B. | 一定条件下,甲、乙均能发生取代反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 甲、乙都能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
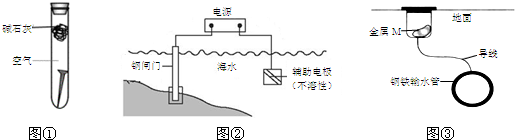
| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
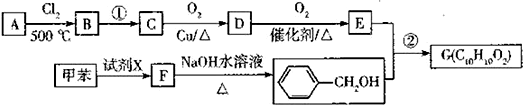
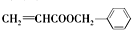 .
.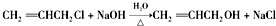 .
.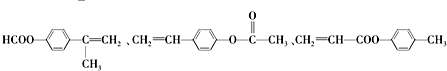 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
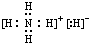 .
.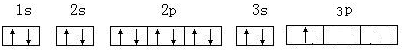 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
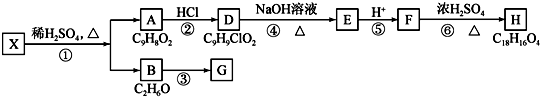
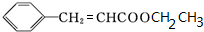 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$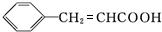 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.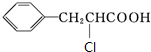 .
.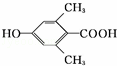 、
、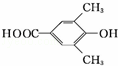 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com