
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图,回答下列问题:
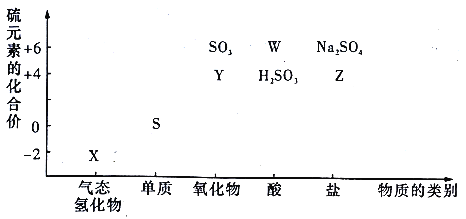
(1)检验Y所用的试剂是_________。
(2)W的稀溶液与铁反应的离子方程式为_________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_________(填标号)。
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)将X与Y的溶液混合,现象为_________,该反应的氧化剂与还原剂的物质的量之比为_________。
【答案】 品红 Fe+2H+=Fe2++H2↑ b 产生淡黄色沉淀 1:2
【解析】X为硫元素的气态氢化物,则X为H2S;Y为硫元素的+4价氧化物,则Y为SO2,Z为+4价的盐,则Z可以为Na2SO3,W为+6价的含氧酸,则W为H2SO4;
(1)Y为SO2,SO2具有漂白性,可以使品红溶液褪色,加热又恢复红色,所以检验SO2的试剂可以是品红溶液。
故答案为:品红;
(2)W的稀溶液是稀硫酸,稀硫酸与铁反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑;
(3)Na2S2O3中S为+2价,从氧化还原的角度分析,可以由高价态的S(大于2)和低价态的S(小于2)发生归中反应,生成+2价的S。a中S化合价都小于2,cd中S的化合价都大于2,b符合题意,故选b;
故答案为:b;
(4)将X(H2S)与Y(SO2)混合,可生成淡黄色沉淀,反应方程式为2H2S+SO2=3S↓+2H2O,H2S中S元素化合价﹣2价变化为0价,做还原剂;SO2中S元素由+4价变化为0价,二做氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2。
故答案为:产生淡黄色沉淀;1:2;


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,如图1是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用且最灵敏的检验试剂为(填试剂的名称).
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为: .
(3)称量上述含铁元素质量分数为20.00%的“速力菲”19.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液.取出20.00mL,用0.01300mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如图2所示.
①实验前,首先要精确配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 .
②某同学的滴定方式(夹持部分略去)如图,最合理的是 . 
③由图可知消耗KMnO4溶液体积为mL;
④滴定终点观察到的现象为;
⑤以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是 .
A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出
B.未用标准KMnO4溶液润洗滴定管
C.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
D.滴定前仰视,滴定后俯视(标准液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与滴定实验有关的说法中正确的是( )
A.容量瓶和滴定管都需要用试剂润洗
B.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高
C.用滴定管准确量取20.0 mL盐酸
D.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

(1)滤渣I的主要成分是_______________(填化学式)。
(2)还原时,试剂X若选用SO2,则反应后溶液中的阴离子是_________________(填化学式)
(3)检验过滤Ⅰ得到的滤液中存在Fe3+的方法是____________________。
(4)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KmnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要___________、________。
②该补血剂中亚铁离子的含量为mg/片(请写出计算过程) ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进 行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能.下列有 关叙述正确的是( ) 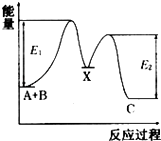
A.E2表示反应X→C的活化能
B.X是反应A十B→C的催化剂
C.反应A十B→C的△H<0
D.加入催化剂可改变反应A十B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
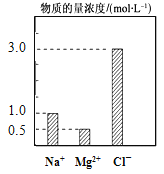
(1)该混合液中,NaCl的物质的量的浓度为 molL-1,含溶质MgCl2的物质的量为 mol。
(2)该混合液中KCl的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+ SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+ SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验:
(1)取少量分解得到的固体加入稀盐酸溶解,为检验溶液中是否有Fe3+,下列试剂或药品中最合适的是 (填序号),加入该试剂后可观察的现象为 。
A.稀盐酸 B.氯气 C.KSCN溶液 D.氯化铜溶液
(2)将高温分解产生的气体通入下图所示装置中,以检验产生的气体成分。
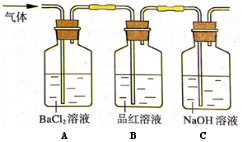
请回答下列问题:
①若在装置A中,观察到有白色沉淀生成,则该沉淀为 ,表明有 气体存在。
②装置C中的NaOH溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 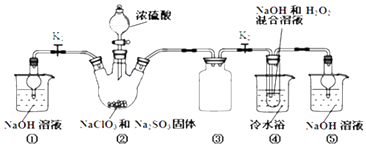
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测,氨有望取代氢能,成为重要的新一代绿色能源.下列有关说法不正确的是( )
A.液氨作为清洁能源的反应原理是4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g?L﹣1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com