

| c(CO)?c(H2) |
| c(H2O) |
| c(CO)?c(H2) |
| c(H2O) |
| ||||
|
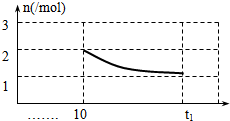 ,故答案为:
,故答案为: .
.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最终得到沉淀质量为36g |
| B、该硫酸溶液中硫酸的物质的量浓度是0.4mol/L |
| C、在稀硫酸刚好完全反应后的溶液中加入KSCN溶液,溶液会出现红色 |
| D、混合物中氧的质量分数约为14.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NO的质量是30g |
| B、标准状况下,1 mol H2O的体积是22.4 L |
| C、17 g NH3含有的氢原子总数为6.02×1023 |
| D、100 mL 0.1 mol/L Na2CO3溶液中,Na+的物质的量为 0.01 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图中“过量的金属”可以是Na、Mg或Fe |
| B、反应开始时的速率:v(H2SO4)>v(HCl)>v(HAc) |
| C、最终得到氢气的体积:V H2SO4(H2)=VHCl(H2)=VHAc(H2) |
| D、所选用量筒的规格决定于金属的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com