
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《物质结构与性质》模块试题
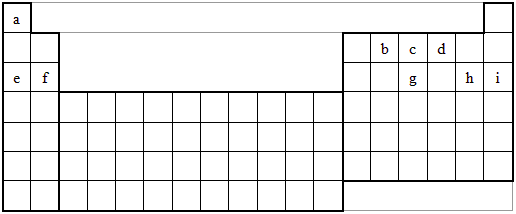
1.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式 ① 。
(2)d的氢化物的分子构型为 ② ,中心原子的杂化形式为 ③ ;k在空气中燃烧产物的分子构型为 ④ ,中心原子的杂化形式为 ⑤ ,该分子是 ⑥ (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表 ⑦ (填元素符号);其中电负性最大的是 ⑧ (填下图中的序号)。

(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 ⑨ ,试从结构角度加以解释: ⑩ 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为![]() ,一个晶胞中i原子的数目为
,一个晶胞中i原子的数目为![]() 。
。
②该晶体的密度为![]() (用字母表示)。
(用字母表示)。
2.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ① ,G ② 。
(2)D的前一元素第一电离能高于D的原因: ③ 。
(3)由A、B、C形成的ABC分子中,含有 ④ 个σ键, ⑤ 个π键。
(3)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ⑥ (写化学式),原因是 ⑦ 。
《有机化学基础》模块试题
3.M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命,M5纤维是线型结构且又有分子间氢键的聚合物,在三维方向x、y、z上,当方向z是聚合物主链方向时,在x方向和y方向上的氢键是其晶体结构的特征。下面是M5纤维的合成路线(部分反应未注明条件):

请回答:
(1)合成M5的单体的结构简式:F ① ,G ② 。
(2)反应类型:A![]() B: ③ ,B
B: ③ ,B![]() C: ④ 。
C: ④ 。
(3)生成A的同时可能生成的A的同分异构体: ⑤ 。
(4)写出化学反应方程式:C![]() 对苯二甲酸: ⑥ ;D
对苯二甲酸: ⑥ ;D![]() E: ⑦ 。
E: ⑦ 。
(5)1 mol的F与NaHCO3溶液反应,最多耗NaHCO3 ⑧ mol。
(6)M5纤维分子间为什么会有氢键?请分析说明: ⑨ 。
4.现有A、B、C、D四种有机物,已知:它们的相对分子质量都是104;A是芳香烃,B、C、D均为烃的含氧衍生物,四种物质分子内均没有甲基;A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(反应方程式未注明条件):
①nA![]() X ②nB
X ②nB![]() Y(聚酯)+nH2O ③nC+nD
Y(聚酯)+nH2O ③nC+nD![]() Z(聚酯)+2nH2O
Z(聚酯)+2nH2O
请按要求填空:
(1)A的结构简式是 ① ,Z的结构简式是 ② 。
(2)在A中加入少量溴水并振荡,所发生反应的化学方程式: ③ 。
(3)B的同分异构体有多种,其中分子中含结构![]() 的同分异构体的结构简式分别是 ④ 。
的同分异构体的结构简式分别是 ④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)下图是元素周期表的部分框架,请回答:
| ① |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
| ② | ③ | ④ |
|
|
|
|
| ⑤ | ⑥ |
| ⑦ |
|
⑴根据元素周期表回答下面问题:
a)元素周期表中的元素⑤和元素⑥的最高价氧化物的水化物中酸性较强是 (用化学式表示)。用电子式表示元素①与④的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
b)元素①—⑦中的某单质在常温下化学性质稳定,通常可以做保护气的是 (用电子式表示)。
c)碳、氢两种元素能形成许多种化合物,有些分子还会形成同分异构体。写出与己烷互为同分异构体,且一氯代物有两种的化合物的结构简式并命名
⑵元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线原则。根据元素周期表对角线原则,金属Be与铝单质及其化合物性质相似。
a)写出证明Al2O3是两性物质的化学反应的离子方程式:
, 。
b)Be(OH)2和Mg(OH)2可用试剂 鉴别。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省泰州中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(18分)下图是元素周期表的部分框架,请回答:
| ① | | | | | | | | | | ||||||
| | | | | | | | ② | ③ | ④ | | |||||
| | | | ⑤ | ⑥ | | ⑦ | | ||||||||
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一下学期期中考试化学试卷(解析版) 题型:填空题
(18分)下图是元素周期表的部分框架,请回答:
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
③ |
④ |
|
|
|
|
|
⑤ |
⑥ |
|
⑦ |
|
⑴根据元素周期表回答下面问题:
a)元素周期表中的元素⑤和元素⑥的最高价氧化物的水化物中酸性较强是 (用化学式表示)。用电子式表示元素①与④的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
b)元素①—⑦中的某单质在常温下化学性质稳定,通常可以做保护气的是 (用电子式表示)。
c)碳、氢两种元素能形成许多种化合物,有些分子还会形成同分异构体。写出与己烷互为同分异构体,且一氯代物有两种的化合物的结构简式并命名
⑵元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线原则。根据元素周期表对角线原则,金属Be与铝单质及其化合物性质相似。
a)写出证明Al2O3是两性物质的化学反应的离子方程式:
, 。
b)Be(OH)2和Mg(OH)2可用试剂 鉴别。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com