
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇 水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式_________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________。
水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式_________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________。
(2)下列有关硅材料的说法正确的是__________________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释__________________________ _____。
_____。
【答案】
(1)①SiHCl3+H2 Si+3HCl
Si+3HCl
②SiHCl3+3H2O H2SiO3+H2↑+3HCl 高温下,H2遇O2发生爆炸
H2SiO3+H2↑+3HCl 高温下,H2遇O2发生爆炸
(2)ABCD
(3)生成白色絮状沉淀,有刺激性气味的气体生成;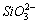 与
与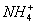 发生双水解反应,
发生双水解反应,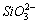 +2
+2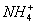 +2H2O
+2H2O 2NH3·H2O+H2SiO3↓
2NH3·H2O+H2SiO3↓
【解析】(2)SiC和Si3N4均为原子晶体,熔点高,性质稳定,A、B正确。光导纤维的材料为SiO2,C正确。普通玻璃的主要成分为Na2SiO3和CaSiO3,它是以石英砂(SiO2)、石灰石(CaCO3)和纯碱(Na2CO3)为主要原料反应制成的。Na2CO3+SiO2 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 CaSiO3+CO2↑,D正确,常温下,Si只能与唯一一种酸HF反应不与HCl反应,E错。
CaSiO3+CO2↑,D正确,常温下,Si只能与唯一一种酸HF反应不与HCl反应,E错。


科目:高中化学 来源: 题型:
下列单质或化合物性质的描述正确的是( )
A.NaHSO4水溶液显中性
B.SiO2与酸、碱均不反应
C.NO2溶于水时发生氧化还原反应
D.Fe在足量Cl2中燃烧生成和FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)====N2O4(g) ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)  N2O4(g)达到平衡。
N2O4(g)达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是______________(填字母)。
A.减小NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
(2)25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)====3N2(g)+4H2O(l)的ΔH=____________________kJ·mol-1。
(3)17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0 mol·L-1、c(N2O4)=0.012 0 mol·L-1。计算反应2NO2(g)  N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2的混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是( )
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
对于ⅣA族元素,下列叙述中不正确的是
A.SiO2和CO2中,Si和O,C和O之间都是共价键
B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.该族元素的主要化合价是+4和+2
查看答案和解析>>
科目:高中化学 来源: 题型:
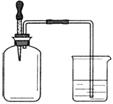
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是
A.KClO3(加MnO2催化剂,加热) B.KMnO4(加热)
C.H2O2(水溶液,加MnO2催化剂) D.HgO(加热)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上对海水资源综合开发利用的部分工艺流程如下图所示。
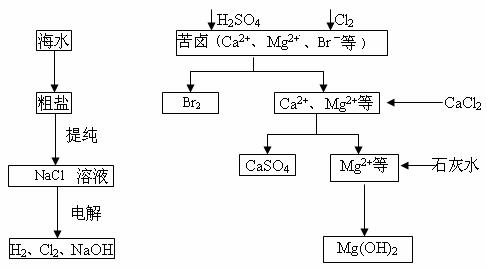
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是______________。电解槽中的阳极材料为__________________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2和CaSO4的顺序制备?______________________原因是______________________。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 32gO2占有的体积约为22.4L |
|
| B. | a L甲烷和乙烷混合气体中的分子数约为 |
|
| C. | 在标准状况下,22.4L水的质量约为18g |
|
| D. | 22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com