
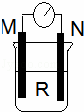
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是()
M N R
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 铁 铜 硝酸银
D 铜 铁 氯化铁
A. A B. B C. C D. D
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 该原电池中,M棒变细,N棒变粗,则M作负极,负极上失电子发生氧化反应,N是正极,正极上金属阳离子得电子发生还原反应.
解答: 解:A.锌的活泼性大于铜,所以锌作负极,铜作正极,但铜电极上氢离子放电,故A错误;
B.铁的活泼性大于铜,所以铁作负极,故B错误;
C.铁的活泼性大于铜,铁作负极,铜作正极,正极上银得电子析出银,故C正确;
D.铁的活泼性大于铜,铁作负极,铜作正极,正极上铁离子得电子生成亚铁离子,故D错误;
故选C.
点评: 本题考查了原电池原理的分析判断,电极名称,电极判断和电极反应是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
如图表示从烷烃A开始的一系列反应(部分条件、试剂被省略),化合物B中仅有3个碳原子、1个溴原子、2种氢原子.回答下列问题:
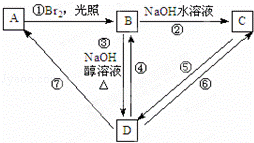
(1)属于取代反应的有 (填框图中序号,下同),属于加成反应的有 ,属于消去反应的有 ;
写出下列反应的化学方程式:
(2)B→D
(3)D在一定条件下生成高分子化合物:
查看答案和解析>>
科目:高中化学 来源: 题型:
为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g) CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s 0 500 1 000
c(H2)/(mol•L﹣1) 5.00 3.52 2.48
c (CO)/(mol•L﹣1) 2.50
1.76
1.24
(1)在500s内用H2表示的化学反应速率是
(2)在1 000s内用CO表示的化学反应速率是,1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是.
查看答案和解析>>
科目:高中化学 来源: 题型:
类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( )
A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
 Co是γ放射源,
Co是γ放射源, Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对
Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对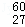 Co原子的叙述不正确的是()
Co原子的叙述不正确的是()
A. 质量数是60 B. 质子数是60 C. 中子数是33 D. 电子数是27
查看答案和解析>>
科目:高中化学 来源: 题型:
在银锌原电池中,以硫酸铜为电解质溶液,锌为极,电极上发生的是反应(“氧化”或“还原”),电极反应式为,锌片上观察到的现象为.银为正极,电极上发生的是反应(“氧化”或“还原”),电极反应式是,银片上观察到的现象是.
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)()
A. 
用装置甲检验溶液中是否有K+
B. 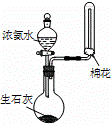
用装置乙制取并收集少量NH3
C. 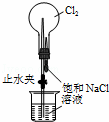
用装置丙进行喷泉实验
D. 
用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
硝铝[Al(NO3)3]是一种常用媒染剂.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如图甲:
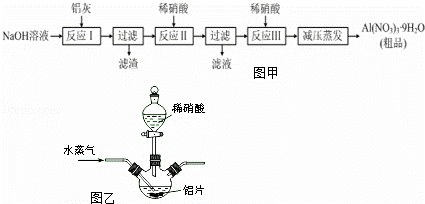
(1)写出反应Ⅰ的离子方程式: )(任写一个).
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是),可采取的措施为
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是.
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是.
(5)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是.
查看答案和解析>>
科目:高中化学 来源: 题型:
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)1个NH4+的电子数为_______个,沸点PH3_______NH3(填大于、小于或等于)。
(2)NaNO2有毒,与食醋共熟会生成两种中学常见的氮氧化物气体,该反应的离子方程式为__________________________________________
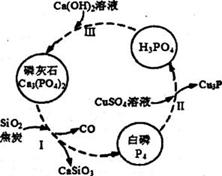
(3)磷及部分重要化合物的相互转化关系如下图所示。
①白磷(P4)的晶体类型为____________________。
②步骤I是白磷(P4)的工业生产方法。反应在高温条件下进行,其中SiO2的作用是用于造渣
(CaSiO3),焦炭的作用是作______________。 (填氧化剂或还原剂)
③不慎将自磷(P4)沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4
所能氧化的自磷(P4)的物质的量为___________
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5(PO4)3OH(ksp=6.8×10﹣37)。人们常使用舍氟离子的牙膏防蛀牙,其中的氟化物可使羟基磷灰石转化为氟磷灰石Ca5(PO4)3F(Ksp=1.0×10﹣60)。写出该反应的离子方程式_____________________,该反应的平衡常数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com