
 CH2-CH2↑+H2O,
CH2-CH2↑+H2O, CH2CH2↑+H2O;
CH2CH2↑+H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
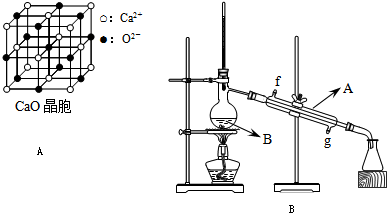
| ||
| ||


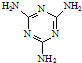 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 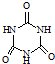 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法正确的是____________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol·L-1到0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
②样品处理:

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01 mol·L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:_______________、_______________。
②步骤②脱色过程包括加入____________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
③步骤②样品处理中,氧化的目的是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com