
分析 (1)碳酸氢钠受热分解依据化学方程式定量关系计算分析,碳酸氢钠完全分解生成固体为碳酸钠;
(2)结合反应前后固体质量变化计算NaHCO3部分分解,此时NaHCO3和Na2CO3的质量.
解答 解:(1)把A克固体碳酸氢钠加热分解,冷却称重固体质量为B克,NaHCO3完全分解得到固体为碳酸钠,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2×84 106
Ag Bg
B=$\frac{106A}{168}$=$\frac{53A}{84}$,
故答案为:$\frac{53A}{84}$.
(2)NaHCO3部分分解,反应前后固体质量变化分析,B的取值范围为:0<B<$\frac{53A}{84}$,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84 106 62
$\frac{168(A-B)}{62}$ g $\frac{106(A-B)}{62}$ g ( A-B)g
此时NaHCO3质量=Ag-$\frac{168(A-B)}{62}$g=$\frac{84B-53A}{31}$g,Na2CO3质量=$\frac{106(A-B)}{62}$g=$\frac{52(A-B)}{31}$g
故答案为:$\frac{84B-53A}{31}$g;$\frac{52(A-B)}{31}$g.
点评 本题考查了化学方程式的计算,注意反应前后差量计算的应用,掌握基础是解题关键,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:实验题

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
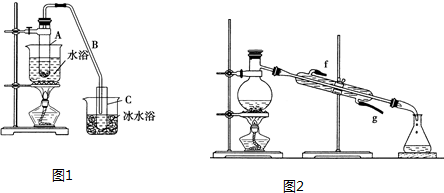
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化钠溶液做导电实验,灯泡发光:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- | |
| B. | 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
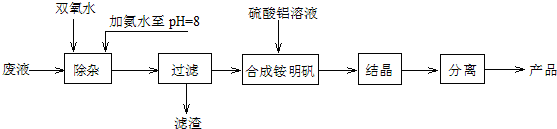
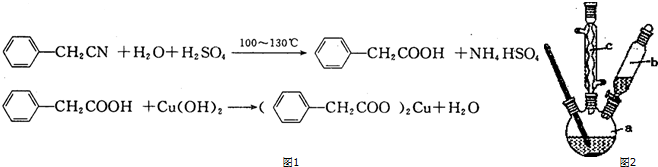
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com