
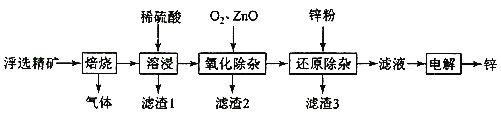
����Ŀ���ҹ��������������Ƶú�ʹ�ý���п�Ĺ��ң�һ������п��ZnS������SiO2������FeS��CdS��PbS���ʣ�Ϊԭ���Ʊ�����п��������ͼ��ʾ��
��ؽ�������[c0(Mn+)=0.1 mol��L-1]�γ��������������pH��Χ���£�
�������� | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
��ʼ������pH | 1.5 | 6.3 | 6.2 | 7.4 |
������ȫ��pH | 2.8 | 8.3 | 8.2 | 9.4 |
��ش��������⣺
��1�����չ����в��������廯ѧʽ__��
��2���ܽ�ʱ����߽����ʵķ�����____��������д�����֣�
��3������Fe(OH)3����Һ�뺬SO2��������Ӧ����FeSO4������ʹ�������÷�Ӧ�����ӷ���ʽΪ__������FeSO4�ڿ�������������������������÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ__��
��4����������ʱ������ZnO������ҺpH�����ù㷺pH��ֽ���pHֵΪ___ʱ������Ϊ�Ѵ����Ŀ�ġ�
A��2 B��2.8 C��4 D��6.2
��5������3�ɷ�Ϊ______��
��6��������п��ֱ�ӽ���ϡ���ᣬҪʹ0.10 molZnS��ȫ����1LH2SO4��������ӦZnS+H2SO4 =ZnSO4+H2S��������H2SO4�����Ũ��Ϊ___����Ksp[ZnS]��2.5��10��22��H2S��K1��1��10��7��K2��1��10��14�����Է�Ӧǰ��Һ������仯��
���𰸡�SO2 ���¡����顢���衢�������Ũ�ȡ��ӳ��ܽ�ʱ��� 2Fe(OH)3+SO2+2H+=2Fe2++SO42-+4H2O 1:4 C Cd��Zn 0.2 mol/L
��������
��п����ʱ��SԪ����������Ӧ���ɶ����������壻���ʱ���������������ᷴӦ������Ӧ���Σ�PbSO4���������費�����ᣬ������1ΪPbSO4���������裻��������ZnO����pH��ȥFeԪ�أ�����Zn�۳�ȥ��Һ�е�Cd2+���ӣ�
��1�����չ����н�����ת��Ϊ������������ΪSO2��
��2�������¶ȡ�������鼰�������Ũ�ȿɼӿ췴Ӧ���ʣ�����߽����ʵķ��������¡����顢���衢�������Ũ�ȡ��ӳ��ܽ�ʱ��ȡ�
��3��Fe(OH)3����ʱ��Fe(OH)3����Һ�뺬SO2��������Ӧ����FeSO4������2Fe(OH)3+ SO2+2H+=2Fe2++SO42-+4H2O��FeSO4�ڿ��������յĹ�������Ϊ��ԭ��FeSO4��Fe2+���ϼ�����1����������4�����ϼ�����������ȣ����������ͻ�ԭ�������ʵ���֮��Ϊ1:4��
��4������������ZnO����pH����2.8~6.2֮�䣬�����ǵ��㷺pH��ֽ�ľ���Ϊ��������ΪC��
��5����ԭ������������Һ�н��������ӻ���Cd2+��Zn2+��������ý���Zn�Ļ�ԭ���û�������Cd������п�۹���������3ΪCd��Zn��
��6���������⣬��0.10 mol ZnS��ȫ����1LH2SO4ʱ
ZnS + H2SO4 == ZnSO4 + H2S
0.10 0.10 0.10 0.10
��C(Zn2+)=0.10 mol/L��C(H2S)=0.10mol/L��C(S2)=Ksp(ZnS)/C(Zn2+)=2.5��10��21��K1 K2= C2 (H +)�� C(S2)/C(H2S)=1��10��21��C(H+)=0.20 mol/L��C(H2SO4 )=0.10+0.10=0.20mol/L��


 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ڼ��������µķ�Ӧ�������������ֲ�ͬ�Ĺ۵㣺
�������������ƾ�Ϊǿ�����������߲���Ӧ��
���ܷ�Ӧ����������������
���ܷ�Ӧ��������������������Ϊ���������۵����α������������̽��ʵ�飺

�ش��������⣺
��1���������Ƶĵ���ʽΪ________����װ���з�����Ӧ�����ӷ�Ӧ����ʽΪ___��
��2�������������Ϊ___��������Ϊ___��
��3��Ϊ�������ʵ��Ŀ�ģ�����������˳��Ϊa__�����ȱ�ٱ�װ�ã� ��װ���з����ķ�ӦΪ____��
��4��ʵ�������Ϊ��֤�۵���Ƿ���ȷ�����һ�����е�ʵ�����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȼ��仯��������ѧ��ѧ��Ҫ����ɲ��֡�
��1������ȼ�ϵ��ʹ�õĵ������Һ��KOH��Һ����ط�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��ӦʽΪ__________���øõ�ؽ��д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫������CuSO4��ҺΪ�������Һ������˵����ȷ����________��
a������ȫ��ת��Ϊ��ѧ��
b��SO42�������ʵ���Ũ�Ȳ��䣨��������Һ����仯��
c����Һ��Cu2+�������ƶ�
d������������ɻ���Ag��Pt��Au�Ƚ���
e����������������64g����ת�Ƶ�����Ϊ2NA��
��2���ٽ�SO2ͨ�뵽BaCl2��Һ�У��������쳣�����������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣������������ʵ�����̣���������Һ![]() ��ɫ����
��ɫ����![]() �۲������жϣ����Լ�A�Ļ�ѧʽΪ_________��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��________��
�۲������жϣ����Լ�A�Ļ�ѧʽΪ_________��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��________��
��������ͼ��ʾ�绯ѧװ�����չ�ҵβ����SO2������������Cu��д��װ���������ĵ缫��Ӧʽ_________��
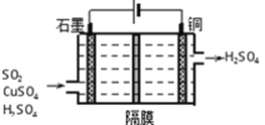
��3����֪Ksp��BaSO4��=1.0��10��10��Ksp��BaCO3��=2.5��10-9��ijͬѧ�������������̵õ�BaCl2��BaSO4![]() BaSO3
BaSO3![]() BaCl2����ٵ����ӷ���ʽΪ________���÷�Ӧ��ƽ�ⳣ��K=_________��
BaCl2����ٵ����ӷ���ʽΪ________���÷�Ӧ��ƽ�ⳣ��K=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��C��D�����ʻ�ṹ��Ϣ���£�
��Ϣ����ԭ�Ӱ뾶��A<B<C<D��������Ԫ��֮���γɵ�ij���ַ��ӵı���ģ�ͼ������������£�
���� | ����ģ��ͼ | ���ڻ����� |
�� |
| �ǵ��������������֮һ���������������������Ҫ��Դ��Լռ�������ص�����֮�� |
�� |
| ��ɫ������ζ������ȼ���dz�����һ�ֻ�����Դ |
�� |
| ��ǿ�����Ե����ᣬ��Ư���ԣ�����������ɱ�� |
�����������Ϣ�ش��������⡣
��1��A��Ԫ�ط�����___��CԪ����Ԫ�����ڱ��е�λ����___���ĵ���ʽ��___��
��2��������DԪ�صĵ��������ʼ�Ӧ�õ����÷�Ӧ�����ӷ���ʽ��___��D���������У�EԪ�صĵ��ʻ�ԭ����ǿ����E�ĵ������Ӧ�����Һ��___���������������������ԣ��õ��뷽��ʽ��ʾ��ԭ����___��
��3����A��B��CԪ�ؿ���ɶ��ֻ������A��C��ɵ�һ�ֻ����ﶡ�������������������һ������ʯ�ͻ�����չˮƽ����ʵ�����п�������ȥ����������������___��
��A��C��ɵĻ������У���ѧʽΪC2A6����������D�ĵ��ʷ�����Ӧ������___��д������һ����ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���������ó��Ľ��۲���ȷ����
ѡ�� | ʵ������ | ʵ����� |
A | ����Ƭ�ֱ�Ͷ��Ũ��ϡ�����У� ǰ�������������߷�Ӧ���� | ϡ����������Ա�Ũ�����ǿ |
B | ����з�̪��Na2CO3��Һ�� ����BaCl2��Һ����ɫ��dz | Na2CO3��Һ�д���ˮ��ƽ�� |
C | ij��Һ�еμӹ�����ˮ���� ��ɫ�����Ҳ��ܽ� | ����Һ�п��ܺ���Mg2+ |
D | ��ˮ��ͨ��SO2����ˮ��ɫ | SO2���л�ԭ�� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����û������������þ���20�����ӵĸ�Ԫ�ص�ͬλ�ط��������95�����ӵ���Ԫ�أ����4�γɹ��Ƴ�4����115��Ԫ�ص�ԭ�ӡ���4��ԭ�������������˥��ɵ�113��Ԫ�ء�ǰ�ߵ�һ�ֺ���Ϊ![]() �������й�������ȷ���ǣ� ��
�������й�������ȷ���ǣ� ��
A.��Ԫ������Ԫ���Ƴɵ�115��Ԫ�����ڻ��Ϸ�Ӧ
B.113��Ԫ���������ӦΪ+3
C.����![]() ����������������֮��Ϊ174
����������������֮��Ϊ174
D.115����113��Ԫ�ص����ԭ������֮��115��113
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽⷴӦ�Ĵ�Ч������λͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣������������ȷ���ǣ� ��
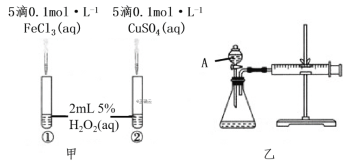
A.ͼ����ʾʵ���ͨ���۲�������ݵĿ������ȽϷ�Ӧ���ʵĴ�С
B.��ͼ����ʾʵ���з�Ӧ����Ϊ��>�ڣ���˵��Fe3+һ����Cu2+��H2O2�ֽ�Ĵ�Ч����
C.��ͼ����ʾװ�òⶨ��Ӧ���ʣ��ɲⶨ��Ӧ�����������������Ӧʱ��
D.Ϊ���ͼ����ʾװ�õ������ԣ��ɹر�A����������ע������������һ�����룬һ��ʱ����ɿ��������۲�����Ƿ�ص�ԭλ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���˵������ȷ����
A. ����ͼ������ƽ�������壬����ʱ����Ӧ�ر�

B. ��������ƽ��ȡ10.2 g NaOH����ʱ����10g������������̣��������Ƶ�0.2g��λ��
C. �ֹ��ȼƿ����ڷ�����Һ��ɫ�뷴Ӧ��(������)Ũ�ȵĹ�ϵ���Ӷ�ȷ����ѧ��Ӧ����
D. �����������Ȼ�������ʱ�������������ƾ������ѵĻ�������ⶾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���� K3[Fe(C2O4)3]��3H2O�Ǵ���ɫ���壬��421��553��ʱ���ֽ�ΪFe2O3��K2CO3��CO��CO2��H2O��ʵ�����ɲ�����������(FeC2O4��H2O)�������(K2C2O4)������(H2C2O4)��˫��ˮ(H2O2)����Ʊ�����ش���������
��1��д��H2O2�ĵ���ʽ:____________________
��2����ƽ�÷���ʽ____FeC2O4��H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]��3H2O
��3���Ʊ�������Ҫ��ֹ���ᱻH2O2��������д�����ᱻH2O2�����Ļ�ѧ��Ӧ����ʽ______��
��4���������ȶ��Կ������ȶ�����K����������Cu2++4NH3��[Cu(NH3)4]2+�����ȶ���������ʽΪ:![]() ����֪K[Fe(C2O4)3]3��=1020�� K[Fe(SCN)3]=2
����֪K[Fe(C2O4)3]3��=1020�� K[Fe(SCN)3]=2![]() 103���ܷ���KSCN��Һ����K3[Fe(C2O4)3]��3H2O�е���Ԫ��?______(����������������)��ѡ������������Ƽ�����Ԫ�صķ���_________________________________________��
103���ܷ���KSCN��Һ����K3[Fe(C2O4)3]��3H2O�е���Ԫ��?______(����������������)��ѡ������������Ƽ�����Ԫ�صķ���_________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com