
分析 (1)根据实验现象,确定维生素C的性质,缺少维生素C会患坏血病;
(2)设人体的质量为m,则人体中该元素原子的物质的量=m×$\frac{质量分数}{该元素的摩尔质量}$;
(3)抗酸药匙和胃酸中盐酸发生反应.
解答 解:(1)向一片新鲜水果的切面上滴加淀粉溶液和碘水,出现蓝色后又慢慢褪去,说明维生素C把单质碘还原为碘离子,故维生素C具有还原性,缺少维生素C医患坏血病,故答案为:坏血;褪色;还原;
(2)设人体的质量为m,则人体中该元素原子的物质的量=m×$\frac{质量分数}{该元素的摩尔质量}$,所以
n(C)=m×$\frac{18%}{12}$=0.012mmol,n(H)=m×$\frac{10%}{1}$=0.1mmol,n(O)=m×$\frac{65%}{16}$=0.041mmol
故答案为:H;
(3)该抗酸药的常数主要是氢氧化铝,和盐酸反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O.
点评 本题考查了化学与生活的关系、物质的量的有关计算,题目难度不大,但易错,注意把握物质的量与质量有关计算公式的运用.


科目:高中化学 来源: 题型:解答题

| 空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
| 59.60g | 65.60g | 64.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳-碳原子间是非极性共价键 | |
| B. | 光照下能够发生取代反应 | |
| C. | 比丁烷更易液化 | |
| D. | 是石油分馏的一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该物质分子式为C13H14O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 在一定条件下可发生加成、取代、消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
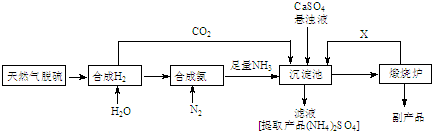

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com