
TΓφ ±Θ§‘Ύ1 LΒΡΟή±’»ίΤς÷–≥δ»κ2 mol CO2ΚΆ6 mol H2Θ§“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΖ¥”ΠΘΚ
CO2Θ®gΘ©+3H2Θ®gΘ© CH3OHΘ®gΘ©+H2OΘ®gΘ© ΓςH="-49.0" kJ/mol
CH3OHΘ®gΘ©+H2OΘ®gΘ© ΓςH="-49.0" kJ/mol
≤βΒΟH2ΚΆCH3OHΘ®gΘ©ΒΡ≈®Ε»Υφ ±Φδ±δΜ·«ιΩω»γœ¬ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «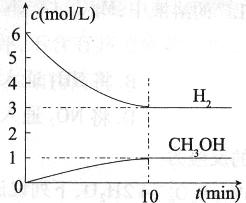
AΘ°0ΓΪ10 minΡΎ Θ®H2Θ©="0.3" mol/Θ®LΓΛminΘ© Θ®H2Θ©="0.3" mol/Θ®LΓΛminΘ© |
| BΘ°TΓφ ±Θ§ΤΫΚβ≥Θ ΐK=1/27Θ§CO2”κH2ΒΡΉΣΜ·¬ œύΒ» |
| CΘ°TΓφ ±Θ§Ζ¥”Π÷–Β±”–32 g CH3OH…ζ≥… ±Θ§Ζ≈≥ω49.0 kJΒΡ»»ΝΩ |
| DΘ°¥οΒΫΤΫΚβΚσΘ§…ΐΗΏΈ¬Ε»Μρ‘Ό≥δ»κCO2ΤχΧεΘ§ΕΦΩ…“‘ΧαΗΏH2ΒΡΉΣΜ·¬ |
D
ΫβΈω ‘ΧβΖ÷ΈωΘΚAΘ°0ΓΪ10minΡΎH2ΒΡΈο÷ ΒΡΝΩ¥”6molΦθ–ΓΈΣ3molΘ§Υυ“‘vΘ®H2Θ©=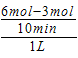 =0.3mol/Θ®LΓΛminΘ©Θ§Ι A’ΐ»ΖΘΜ BΘ°ΤΫΚβ ±cΘ®H2Θ©=3molΓΛLΘ≠1Θ§cΘ®CO2Θ©=1molΓΛLΘ≠1Θ§cΘ®CH3OHΘ©=1molΓΛLΘ≠1Θ§cΘ®H2OΘ©=1molΓΛLΘ≠1Θ§Υυ“‘ΤΫΚβ≥Θ ΐK=
=0.3mol/Θ®LΓΛminΘ©Θ§Ι A’ΐ»ΖΘΜ BΘ°ΤΫΚβ ±cΘ®H2Θ©=3molΓΛLΘ≠1Θ§cΘ®CO2Θ©=1molΓΛLΘ≠1Θ§cΘ®CH3OHΘ©=1molΓΛLΘ≠1Θ§cΘ®H2OΘ©=1molΓΛLΘ≠1Θ§Υυ“‘ΤΫΚβ≥Θ ΐK= =
=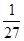 Θ§CO2ΚΆH2ΒΡΉΣΜ·¬ ΨυΈΣ50%Θ§Ι B’ΐ»ΖΘΜCΘ°”…ΆΦΩ…÷ΣΘ§ΤΫΚβ ±…ζ≥…1molCH3OHΘ§Ζ≈≥ω»»ΝΩΈΣ49kJΘ§64gCH3OHΒΡΈο÷ ΒΡΝΩΈΣ
Θ§CO2ΚΆH2ΒΡΉΣΜ·¬ ΨυΈΣ50%Θ§Ι B’ΐ»ΖΘΜCΘ°”…ΆΦΩ…÷ΣΘ§ΤΫΚβ ±…ζ≥…1molCH3OHΘ§Ζ≈≥ω»»ΝΩΈΣ49kJΘ§64gCH3OHΒΡΈο÷ ΒΡΝΩΈΣ =2molΘ§Υυ“‘Ζ≈≥ω98.0kJΒΡ»»ΝΩΘ§Ι C’ΐ»ΖΘΜDΘ°ΓςHΘΦ0Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§H2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΕχΤΫΚβΚσ‘Ό≥δ»κCO2ΤχΧεΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Ω…“‘ΧαΗΏH2ΒΡΉΣΜ·¬ Θ§Ι D¥μΈσΘΜ
=2molΘ§Υυ“‘Ζ≈≥ω98.0kJΒΡ»»ΝΩΘ§Ι C’ΐ»ΖΘΜDΘ°ΓςHΘΦ0Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§H2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΕχΤΫΚβΚσ‘Ό≥δ»κCO2ΤχΧεΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Ω…“‘ΧαΗΏH2ΒΡΉΣΜ·¬ Θ§Ι D¥μΈσΘΜ
ΩΦΒψΘΚΩΦ≤ιΈο÷ ΒΡΝΩΜρ≈®Ε»Υφ ±ΦδΒΡ±δΜ·«ζœΏΘΜΜ·―ßΤΫΚβΒΡΦΤΥψΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
‘Ύ10 LΟή±’»ίΤς÷–Θ§1 mol AΚΆ3 mol B‘Ύ“ΜΕ®ΧθΦΰœ¬Ζ¥”ΠΘΚAΘ®ΤχΘ©ΘΪxBΘ®ΤχΘ©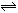 2CΘ®ΤχΘ©Θ§2minΚσΖ¥”Π¥οΒΫΤΫΚβ ±Θ§≤βΒΟΜλΚœΤχΧεΙ≤3Θ°4 molΘ§…ζ≥…0Θ°4 mol CΘ§‘ρœ¬Ν–ΦΤΥψΫαΙϊ≤Μ’ΐ»ΖΒΡ «Θ® ΓΓ Θ©
2CΘ®ΤχΘ©Θ§2minΚσΖ¥”Π¥οΒΫΤΫΚβ ±Θ§≤βΒΟΜλΚœΤχΧεΙ≤3Θ°4 molΘ§…ζ≥…0Θ°4 mol CΘ§‘ρœ¬Ν–ΦΤΥψΫαΙϊ≤Μ’ΐ»ΖΒΡ «Θ® ΓΓ Θ©
| AΘ°ΤΫΚβ ±Θ§Έο÷ ΒΡΝΩ±»AΓΟBΓΟCΘΫ2ΓΟ11ΓΟ4 |
| BΘ°x÷ΒΒ»”Ύ4 |
| CΘ°BΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ0Θ°04 molΓΛL-1ΓΛmin-1 |
| DΘ°AΒΡΉΣΜ·¬ 20ΘΞ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
Ε‘”ΎΖ¥”ΠA2+3B2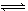 2Cά¥ΥΒΘ§“‘œ¬±μ ΨΒΡΜ·―ßΖ¥”ΠΥΌ¬ ΉνΩλΒΡ «
2Cά¥ΥΒΘ§“‘œ¬±μ ΨΒΡΜ·―ßΖ¥”ΠΥΌ¬ ΉνΩλΒΡ «
AΘ°v (B2)="1.8" molΓΛL-1ΓΛmin-1 BΘ°v (A2)="0.4" molΓΛL-1ΓΛs-1
CΘ°v (C)="0.6" molΓΛL-1ΓΛs-1 DΘ°v (B2)="0.42" molΓΛL-1ΓΛs-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
Ω…ΡφΖ¥”ΠaA(g)+bB(g) cC(g)+dD(s)ΘΜΓςH=QkJΓΛmol-1Θ§Ζ¥”ΠΙΐ≥Χ÷–Θ§Β±ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§Ρ≥Έο÷ ‘ΎΜλΚœΈο÷–ΒΡΚ§ΝΩ”κΈ¬Ε»Θ®TΘ©ΓΔΖ¥”ΠΥΌ¬ Θ®vΘ©”κ―Ι«ΩΒΡΙΊœΒ»γΆΦΥυ ΨΓΘΨίΆΦΖ÷ΈωΘ§“‘œ¬ΥΒΖ®’ΐ»ΖΒΡ «
cC(g)+dD(s)ΘΜΓςH=QkJΓΛmol-1Θ§Ζ¥”ΠΙΐ≥Χ÷–Θ§Β±ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§Ρ≥Έο÷ ‘ΎΜλΚœΈο÷–ΒΡΚ§ΝΩ”κΈ¬Ε»Θ®TΘ©ΓΔΖ¥”ΠΥΌ¬ Θ®vΘ©”κ―Ι«ΩΒΡΙΊœΒ»γΆΦΥυ ΨΓΘΨίΆΦΖ÷ΈωΘ§“‘œ¬ΥΒΖ®’ΐ»ΖΒΡ «
| AΘ°T1ΘΦT2Θ§QΘΨ0 |
| BΘ°‘ω¥σ―Ι«ΩΘ§BΒΡΉΣΜ·¬ Φθ–Γ |
| CΘ°Β±Ζ¥”Π¥οΤΫΚβ ±Θ§ΜλΚœΤχΧεΒΡΟήΕ»≤Μ‘Ό±δΜ· |
| DΘ°a+bΘΨc+d |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
‘ΎΥΡΗω≤ΜΆ§ΒΡ»ίΤς÷–Ϋχ––Κœ≥…Α±ΒΡΖ¥”ΠΓΘΗυΨίœ¬Ν–‘ΎœύΆ§ ±ΦδΡΎ≤βΕ®ΒΡΫαΙϊΘ§≈–Εœ…ζ≥…Α±ΒΡΥΌ¬ ΉνΩλΒΡ «
| AΘ°v (N2)=0Θ°05molΓΛLΘ≠1ΓΛsΘ≠1 | BΘ°v (H2)=0Θ°3molΓΛLΘ≠1ΓΛminΘ≠1 |
| CΘ°v (N2)=0Θ°2 molΓΛLΘ≠1ΓΛminΘ≠1 | DΘ°v (NH3)=0Θ°3 molΓΛLΘ≠1ΓΛminΘ≠1 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
‘ΎΟή±’»ίΤςάοΘ§A”κBΖ¥”Π…ζ≥…CΘ§ΤδΖ¥”ΠΥΌ¬ Ζ÷±π”Ο ΓΔ
ΓΔ ΓΔ
ΓΔ ±μ ΨΘ§“―÷Σ2
±μ ΨΘ§“―÷Σ2 =3
=3 ΓΔ3
ΓΔ3 =2
=2 Θ§‘ρ¥ΥΖ¥”ΠΩ…±μ ΨΈΣ
Θ§‘ρ¥ΥΖ¥”ΠΩ…±μ ΨΈΣ
| AΘ°2A+3B=2C | BΘ°A+3B=2C | CΘ°3A+B=2C | DΘ°A+B=C |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
œ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ « Θ® Θ©
| AΘ°Κœ≥…Α±Ζ¥”Π–η Ι”Ο¥ΏΜ·ΦΝΘ§ΥΒΟς¥ΏΜ·ΦΝΩ…“‘¥ΌΫχΗΟΤΫΚβœρ…ζ≥…Α±ΒΡΖΫœρ“ΤΕ· |
| BΘ°≥ΘΈ¬œ¬Θ§ΫΪpH =10ΒΡΑ±Υ°œΓ ΆΘ§»ή“Κ÷–Υυ”–άκΉ”≈®Ε»ΕΦΦθ–Γ |
| CΘ°100 mL pHΘΫ3ΒΡHAΚΆHBΖ÷±π”κΉψΝΩΒΡ–ΩΖ¥”Π,HAΖ≈≥ωΒΡ«βΤχΕύ,ΥΒΟςHAΥα–‘±»HB»θ |
DΘ°“―÷Σ  I2ΘΪIΘ≠Θ§œρ Δ”–KI3»ή“ΚΒΡ ‘Ιή÷–Φ”»κ ΝΩCCl4Θ§’ώΒ¥Ψ≤÷ΟΚσCCl4≤ψœ‘Ήœ…ΪΘ§ΥΒΟςKI3‘ΎCCl4÷–ΒΡ»ήΫβΕ»±»‘ΎΥ°÷–ΒΡ¥σ I2ΘΪIΘ≠Θ§œρ Δ”–KI3»ή“ΚΒΡ ‘Ιή÷–Φ”»κ ΝΩCCl4Θ§’ώΒ¥Ψ≤÷ΟΚσCCl4≤ψœ‘Ήœ…ΪΘ§ΥΒΟςKI3‘ΎCCl4÷–ΒΡ»ήΫβΕ»±»‘ΎΥ°÷–ΒΡ¥σ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
‘Ύ“ΜΙΧΕ®»ίΜΐΒΡΟή±’»ίΤς÷–Θ§Ω…ΡφΖ¥”ΠΘΚ H2(g) + I2(g) 2HI (g)¥οΒΫΤΫΚβΒΡ±ξ÷Ψ «
2HI (g)¥οΒΫΤΫΚβΒΡ±ξ÷Ψ «
| AΘ°H2ΓΔI2ΓΔHIΒΡΖ÷Ή” ΐ÷°±»ΈΣ1ΓΟ1ΓΟ2 |
| BΘ°ΜλΚœΤχΧεΒΡ―’…Ϊ≤Μ‘ΌΖΔ…ζ±δΜ· |
| CΘ°ΒΞΈΜ ±Φδ…ζ≥…n mol H2Θ§Ά§ ±œϊΚΡ≥…2n mol HI |
| DΘ°ΜλΚœΤχΧεΒΡΟήΕ»±Θ≥÷≤Μ±δ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚΒΞ―ΓΧβ
œ÷”–œ¬Ν–ΝΫΗωΆΦœσΘΚ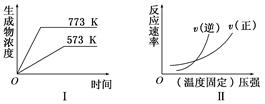
œ¬Ν–Ζ¥”Π÷–ΖϊΚœ…œ ωΆΦœσΒΡ «(ΓΓΓΓ )
AΘ°N2(g) ΘΪ 3H2(g) 2NH3(g)ΓΓ ΠΛHΘΦ0 2NH3(g)ΓΓ ΠΛHΘΦ0 |
BΘ°2SO3(g) 2SO2(g) ΘΪ O2(g)ΓΓΠΛHΘΨ0 2SO2(g) ΘΪ O2(g)ΓΓΠΛHΘΨ0 |
CΘ°4NH3(g) ΘΪ 5O2(g) 4NO(g) ΘΪ 6H2O(g)ΓΓΠΛHΘΦ0 4NO(g) ΘΪ 6H2O(g)ΓΓΠΛHΘΦ0 |
DΘ°H2(g) ΘΪ CO2(g)  CO(g) ΘΪ H2O(g)ΓΓΠΛHΘΨ0 CO(g) ΘΪ H2O(g)ΓΓΠΛHΘΨ0 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com