
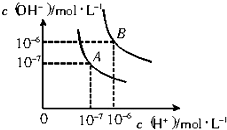
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.分析 (1)结合图示根据水的离子积表达式Kw=c(H+)•c(OH-)及氢氧根离子浓度计算出25℃时和100℃水的离子积;
(2)设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比;
(3)根据H20?H++OH-可知,H2SO4溶液、Ba(OH)2溶液抑制水的电离,根据溶液的H2SO4溶液的PH或Ba(OH)2溶液中c(OH-)计算水的电离的物质的量,Na2S溶液、NH4NO3溶液促进水的电离,根据pH可直接求出发生电离的水的物质的量;
(4)任何电解质溶液中都存在电荷守恒,根据溶液酸碱性结合电荷守恒判断;
(5)①该二元酸第一步完全电离、第二步部分电离,所以其酸根离子能水解导致钠盐呈碱性;酸式酸根离子能电离但不能水解;
②Na2A是强碱弱酸盐,阴离子能发生一步水解生成HA-,但水解程度较小,且溶液中水也电离生成氢离子和氢氧根离子.
解答 解:(1)A点25℃时,c(H+)=c(OH-)=1×10-7mol/L,Kw=c(H+)•c(OH-)=1×10-7×1×10-7=10-14;
100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)•c(OH-)=1×10-6×1×10-6=10-12,
故答案为:10-14;10-12;
(2)设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=10的Ba(OH)2溶液,溶液中c(OH-)=1×10-2mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
混合溶液pH=7,混合溶液中c(OH-)=10-5mol/L,所以$\frac{1{0}^{-2}mol/L×xL-1{0}^{-5}mol/L×yL}{(x+y)L}$=1×10-5mol/L,
解得x:y=2:999,
故答案为:2:999;
(3)设溶液的体积为1L,
①中pH=0的H2SO4中c(H+)=1.0 mol•L-1,c(OH-)=1.0×10-14mol•L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol•L-1,c(H+)=1.0×10-13mol•L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol•L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol•L-1,水的电离的物质的量为1.0×10-5mol;
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,
故答案为:1:10:1010:109;
(4)任何电解质溶液中都存在电荷守恒,如果阴离子物质的量最大,因为溶液体积相同,则阴离子浓度应该最大,假设都是室温下,
①硫酸铜是强酸弱碱盐,铜离子水解导致溶液中c(OH-)<10-7mol/L,则阴离子浓度小于(0.1+10-7)mol/L;
②碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,所以c(H+)<10-7mol/L,根据电荷守恒知,溶液中阴离子浓度等于阳离子浓度=c(Na+)+c(H+)<(0.2+10-7)mol•L-1,但大于0.2mol/L;
③KCl是强碱强酸盐,溶液呈中性,则溶液中c(OH-)=10-7mol/L,溶液中阴离子浓度=(0.1+10-7)mol/L;
④碳酸氢钠是强碱弱酸酸式盐,碳酸氢根电离程度大于其水解程度导致溶液呈碱性,溶液中阴离子浓度等于阳离子浓度<(0.1+10-7)mol/L;
通过以上分析知,阴离子物质的量最大的是②,
故答案为:②;
(5)①Na2A是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性;该二元酸第一步完全电离、第二步部分电离,所以其酸式酸根离子能电离但不能水解,溶液呈酸性,故答案为:碱性;酸性;
②Na2A是强碱弱酸盐,阴离子能发生一步水解生成HA-,但水解程度较小,且溶液中水也电离生成氢离子和氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故选A.
点评 本题考查较综合,涉及弱电解质的电离、pH计算、离子浓度大小比较等知识点,明确溶液中溶质及其性质、弱电解质电离特点及盐类水解特点是解本题关键,难点是(4)题判断,要结合电荷守恒采用等量代换的方法判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色NO 2加压后颜色先变深后变浅 2NO2?N2O4 | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 | |
| D. | H2、I2、HI平衡混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MgBr2
MgBr2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:
一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com