


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe2+ | B.Al3+ | C.Fe3+ | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、NO3-、Fe2+、Na+四种离子在溶液中能够大量共存 |
| B.Cl2通入水中的离子方程式:Cl2+H2O=2H++Cl-+ClO- |
| C.1mol Na2O2中含有2mol阳离子和1mol阴离子 |
| D.向某溶液中加入澄清石灰水变浑浊,再加入盐酸,变澄清且有无色无味气体产生,则原溶液中一定含有碳酸根离子 |
查看答案和解析>>
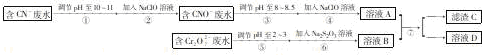
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
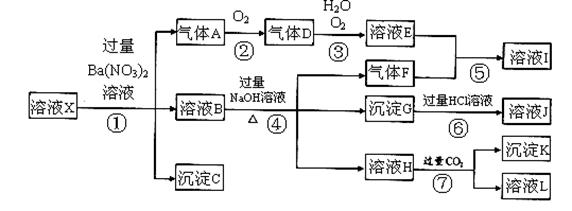
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
查看答案和解析>>
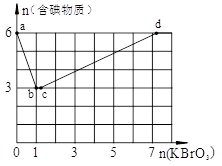
科目:高中化学 来源:不详 题型:计算题
 Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com