
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中正确的是( )

A.W、X、Z可形成离子化合物
B.Z2O是某种弱酸的酸酐,且为直线型分子
C.W与X形成的二元化合物只能含极性键
D.X、Z形成氧化物对应水化物的酸性:Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D,质谱图表明其相对分子质量为86,将8.6gD完全燃烧的产物依次通过装有浓硫酸和碱石灰的装置,浓硫酸中增重9g,碱石灰中增重22g.其相关反应如图所示,其中B、D、E的结构中均含有2个﹣CH3,它们的核磁共振氢谱中均出现4个峰。

请回答:
(1)B中所含官能团的名称为________;D的分子式为________;
(2)Ⅲ的反应类型为________(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ:___________________________________;
Ⅳ:__________________________________;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个﹣CH3 , 它们的结构简式为________和________;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组使用下图装置制取并收集干燥、纯净的氯气,请回答问题:

(1)A装置中仪器a的名称是__________,KMnO4的作用_____________________
(2)C装置盛放的试剂是_______________,其作用是____________________
(3)写出D装置中反应的离子方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为___________。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为_________。
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是___________。
③NH4Cl中存在的作用力有________,NH4Cl熔沸点高于CH3CH2OH的原因是________,Ti(OCH2CH3)4分子中C原子的杂化形式均为__________。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于__________位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为__________m(列出表达式)。
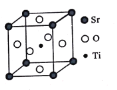
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
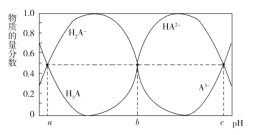
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孟鲁司特钠可用于抗新型冠状病毒肺炎,其制备中间体G 的一种合成路线如下:

已知:① B、C除苯环外还含有一个五元环,D的苯环上只有两个取代基;
②RX![]() RMgX
RMgX
回答下列问题:
(1)A 的化学名称是____________________。
(2)F中含氧官能团名称是____________________________。
(3)B的结构简式为 ______________________________________。
(4)D生成E同时生成乙酸的化学方程式为___________________________________。
(5)E生成F的反应类型是________________。
(6)化合物 W 与G 互为同分异构体,能发生水解反应,其核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则 W 的结构简式为_____________________(写一种) 。
(7)设计以苯甲酸和乙醇为起始原料制备3-苯基-3-戊醇( )的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
)的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计实验,探究“NO2是否能与炽热的铜反应生成氧化铜和氮气”。
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO![]() 和Mn2+
和Mn2+
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。

回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法___。
(2)该实验装置的连接顺序为:___(填装置字母代号),C装置中盛装试剂是___(填名称)。
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是___。
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是___
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是___,写出发生反应的离子方程式___。
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=___(用含m的代数式表示)时,铜被氧化的产物全部是CuO;
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O___(试剂选任)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
Ⅰ. 探究KO2与水的反应:取少量KO2固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加FeCl3溶液,产生的现象为____________________________________。
Ⅱ. 探究KO2与SO2的反应:
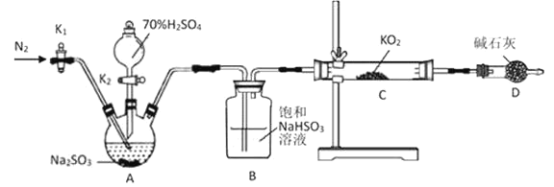
(1)正确的操作依次是_________________________。(操作可重复选择)
①打开K1通入N2,并维持一段时间后关闭
②实验完成,拆卸装置
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(2)A装置发生反应的化学方程式为________________________。
(3)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是________。
(4)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,得沉淀4.66g。
②将N溶液移入锥形瓶中,用0.20mol ![]() L-1酸性KMnO4溶液滴定,当出现___________现象时,达到滴定终点,此时消耗酸性KMnO4溶液20.00mL。
L-1酸性KMnO4溶液滴定,当出现___________现象时,达到滴定终点,此时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出装置C中总反应的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com