
已知: IO3-+5I-+6H+→3I2+3H2O。工业上利用NaIO3和NaHSO3反应来制取单质I2。
①NaIO3不足时:2NaIO3+6NaHSO3→2NaI+3Na2SO4+3H2SO4
②NaIO3足量时:4NaIO3+10NaHSO3→2I2+7Na2SO4+3H2SO4+2H2O
现模拟工业制取I2。在含31.2gNaHSO3的溶液中逐滴加入2mol/LNaIO3溶液vmL。
(1)当v= mL时,再滴NaIO3就开始析出I2。
(2)当v为55mL时,生成的I2的质量为 g。
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 428c |
| a |
| 428c |
| a |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
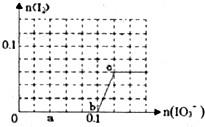 已知:还原性HSO3->I-,氧化性IO3->I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A、0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-═3SO42-+I-+3H+ | B、a点时消耗NaHSO3的物质的量为0.12mol | C、当溶液中I-与I2的物质的量之比为5:2时,加入的KIO3为0.18mol | D、b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
查看答案和解析>>
科目:高中化学 来源:海市奉贤区2012届高三上学期期末调研测试化学试题 题型:058
碘酸钾是一种白色粉末,无臭无味,加碘食盐中常加入它,国家规定每千克食盐中应含40~50 mg碘酸钾酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物制质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氢酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O-6KH(IO3)2+5KCl+3Cl2

1、④的操作名称可能是________.
2、步骤②中,用稀硝酸酸化而不用氢碘酸(HI),其原因可能是________;
3、步骤③要保持溶液微沸1小时是为了排出________,排出该物质的原因为________;
4、X的化学式为________写出用试剂X调节pH的化学方程式________.
5、实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有________;
6、已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-.某学生测定食用精制盐的碘化钾的含量,其步骤为
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液40.0 mL;
d.以淀粉为指示剂,逐滴加入1.00×10-3 mol·L-1碘水10.0 mL恰好反应完全.
Ⅰ.判断d中恰好反应完全的现象是________.
Ⅱ.配平方程式:________IO3-+________I-+________H+→________I2+________H2O
Ⅲ.根据以上实验,所测精制盐中碘酸钾含量是(以含w的代数式表示)________mg/kg.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com