
| m+n |
| a |
| m+n |
| a |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温常压下,13.8g NO2气体溶于足量水,转移电子数为0.2NA |
| B、标准状况下,22.41.CH3CI含有的原子数为5NA |
| C、0.5mo1O2与11.2LO2所含的分子数一定相等 |
| D、常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 的分子式是
的分子式是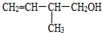 .该有机物中所含官能团的名称是
.该有机物中所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 催化剂 |

| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:

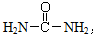 ,请写出尿素的同分异构体中含有离子键的化学式
,请写出尿素的同分异构体中含有离子键的化学式| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2)(moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com