
 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:分析 (1)A.H2C2O4溶液中存在电荷守恒,草酸分步电离;
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根离子水解促进铵根离子水解,亚铁离子水解抑制铵根离子水解;
C.(NH4)2C2O4溶液中存在物料守恒;
D.(NH4)2Fe(SO4)2溶液中铵根离子水解减小,亚铁离子浓度小于铵根离子浓度,溶液中铵根离子和亚铁离子水解显酸性:
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,说明反应生成的锰离子对反应有催化作用;
(3)高锰酸钾溶液具有强氧化性,能腐蚀橡胶管;
(4)到达滴定终点时的现象是滴入最后一滴,溶液紫红色褪去且半分钟不恢复证明反应达到反应终点;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,消耗标准(NH4)2Fe(SO4)2溶液体积增大,则与草酸反应的高锰酸钾溶液体积减小,测定钙离子浓度偏低;
(6)2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,结合反应定量关系,计算过量的KMnO4的物质的量,从而得到与H2C2O4反应的KMnO4的物质的量,5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,据此计算钙离子含量.
解答 解:(1)A.H2C2O4分步电离,溶液中存在电荷守恒,c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A错误;
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根离子水解促进铵根离子水解,亚铁离子水解抑制铵根离子水解,c(NH4+)前者小于后者,故B正确;
C.(NH4)2C2O4溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),故C正确;
D.(NH4)2Fe(SO4)2溶液中铵根离子水解减小,亚铁离子浓度小于铵根离子浓度,:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故D错误;
故答案为:B C;
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,说明反应生成的锰离子对反应有催化作用,反应生成的Mn2+催化了反应的进行,使褪色速率变快,
故答案为:反应生成的Mn2+催化了反应的进行,使褪色速率变快;
(3)高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,12.00mL0.0010mol•L-1的KMnO4溶液应用酸式滴定管,
故答案为:酸式滴定管;
(4)到达滴定终点时的现象是滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色,说明反应达到终点,
故答案为:最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,消耗标准(NH4)2Fe(SO4)2溶液体积增大,过量的KMnO4溶液体积增大,与草酸反应的高锰酸钾物质的量减小,则和草酸钙反应的测得血液中Ca2+的含量将偏低,
故答案为:偏低;
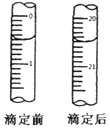
(6)KMnO4的总物质的量为:0.0010 mol•L-1×12×10-3L=1.2×10-5 mol,
2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,结合反应定量关系得到:滴定终点消耗(NH4)2Fe(SO4)2溶液体积读取得到20.00ml,
MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,
1 5
n 0.02000L×0.0020mol•L-1
n=8×10-6mol,
与H2C2O4反应的KMnO4的量为:1.2×10-5 mol-8.0×10-6 mol=4.0×10-6 mol,
5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,
5 2
n 4×10-6mol
n(Ca2+)=1×10-5mol
准确量取5.00mL血液样品,处理后配制成50.00mL溶液中含钙离子物质的量=1×10-5mol×$\frac{50}{10}$=5×10-5mol,
l00mL血液中含Ca2+的质量=$\frac{100}{5}$×5×10-5mol×40g/mol=0.040g,
故答案为:0.040.
点评 本题考查了弱电解质电离、电解质溶液中守恒关系的分析判断、离子反应方程式的书写以及计算、滴定实验过程的理解应用,综合性较强,正确书写离子反应方程式是计算的关键,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com