
在一定温度不同压强(P1<P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
考点:
产物百分含量与压强的关系曲线.
专题:
化学平衡专题.
分析:
一定温度下,增大压强,反应速率增大,到达平衡的时间缩短,该反应正反应是体积增大的反应,平衡向逆反应移动,平衡时Z的物质的量减小,据此结合选项解答.
解答:
解:A、图象中压强p1到达平衡时间短,故图象中p1>p2,与题意不符,故A错误;
B、图象中压强p2到达平衡时间短,图象中p1<p2,增大压强,平衡时生成物Z的物质的量减小,与实际相符,故B正确;
C、图象中压强p1到达平衡时间短,故图象中p1>p2,与题意不符,故C错误;
D、图象中压强p2到达平衡时间短,图象中p1<p2,增大压强,平衡时生成物Z的物质的量增大,与实际不相符,故D错误;
故选B.
点评:
本题考查化学平衡移动图象题,难度中等,注意根据:“先拐先平数值大”判断图象中压强大小.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知,当羟基与双键碳原子相连接时,易发生如下转化:
化学式为C8H8O2的有机物有如下的转化关系:
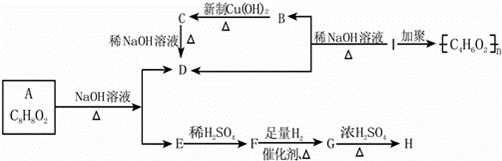 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
回答:(1)结构简式A ,I .
(2)写出反应类型:A→D+E ;F→G .
(3)写出下列反应的化学方程式①I→D+B .②B→D
(4)①与A具有相同官能团、且属于芳香族化合物的同分异构体有 种(不含A),其中不能发生银镜反应的结构简式:.
②在A的同分异构体中既属于酚又属于醛的有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 |
|
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
|
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
|
| D. | 2,3一二甲基丁烷的核磁共振氢谱中会出现两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 凡是放热反应都是自发的,由于吸热反应都是非自发的 |
|
| B. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
|
| C. | 自发反应在恰当条件下才能实现 |
|
| D. | 自发反应在任何条件下都能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸.恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
|
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实不能证明醋酸是弱酸的是( )
|
| A. | 常温下,等浓度的醋酸比盐酸导电能力弱 |
|
| B. | 常温下,测得0.1 mol•L﹣1醋酸溶液的pH=4 |
|
| C. | 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
|
| D. | 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是()
A. Mg2+、H+、Cl﹣、OH﹣ B. Na+、Ba2+、CO32﹣、NO3﹣
C. Na+、H+、Cl﹣、CO32﹣ D. K+、Cu2+、NO3﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com