
分析 ①氯酸钾完全分解生成氧气最多,二氧化锰足量,发生反应:2KCl+MnO2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O,将KCl中Cl元素全部转化为氯气得到氯气的量最大,此时氯酸钾转化率为100%;
②若MnO2不能将KCl中氯元素全部转化为氯气,根据2KCl+MnO2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O,结合Cl原子守恒可以表示出二氧化锰的极大值,表示出反应中消耗KCl的物质的量,氯酸钾部分分解,分解后氯元素全部转化为氯气时,收集到的O2和Cl2的量为最大,根据氯原子守恒可知分解后KClO3、KCl的总物质的量为amol,结合KClO3+5KCl+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3Cl2↑+3K2SO4+3H2O,表示出分解后KClO3的物质的量,进而表示出KClO3的分解率.
解答 解:①氯酸钾完全分解生成氧气最多,二氧化锰足量,发生反应:2KCl+MnO2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O,将KCl中Cl元素全部转化为氯气得到氯气的量最大,此时氯酸钾转化率为100%,此时b≥0.5a,
②若MnO2不能将KCl中氯元素全部转化为氯气,根据2KCl+MnO2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O,结合Cl原子守恒,可知b<0.5a,分解后氯元素全部转化为氯气时,收集到的O2和Cl2的量为最大,根据氯原子守恒可知分解后KClO3、KCl的总物质的量为amol,
2KCl+MnO2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O
2b mol bmol
结合KClO3+5KCl+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3Cl2↑+3K2SO4+3H2O可知,分解后KClO3的物质的量(amol-2b mol)$\frac{1}{6}$,故KClO3的分解率为$\frac{amol-(a-2b)mol×\frac{1}{6}}{amol}$=$\frac{5}{6}$+$\frac{1}{3}$×$\frac{b}{a}$,
答:若要使收集到的O2和Cl2的量为最大,KClO3的分解率是100%(b≥0.5a)或($\frac{5}{6}$+$\frac{1}{3}$×$\frac{b}{a}$)且b<0.5a.
点评 本题考查混合物计算,属于讨论型计算,关键是明确可能发生的反应,利用方程式与守恒法计算解答,侧重考查学生的分析计算能力,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
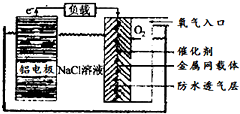 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.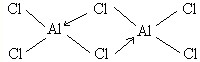 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1 mol Na2CO3晶体中含离子总数大于3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com