
【题目】元素电负性随原子序数的递增而增强的是( )
A. Na、K、Rb
B. N、P、As
C. Si、P、Cl
D. O、S、Cl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】(15分)
(1)一种从废的镀金黄铜零件中回收金的方法:先将零件磨碎,将粉末加入H2SO4和KNO3的混合溶液中,浸泡数小时后,使其完全溶解,然后将沉淀物滤出。上述方法中,将废料磨碎的目的是_________,溶出铜的离子方程式为____________________。
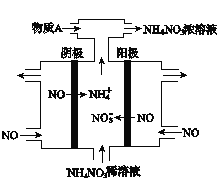
(2)工业上采用电解法处理NO制备NH4NO3。工作原理如图所示,则阳极的电极反应式为________,通入的物质X的化学式为____________,若电路中通过15mol电子,则理论上最多可制备NH4NO3的物质的量为_________。
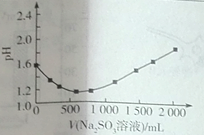
(3)如图是从含有CuCl2的酸性蚀刻液中制取无机催化剂CuCl的流程:

①反应I进行时,反应体系的pH与Na2SO3溶液的添加量的关系如图所示,则反应I的离子方程式为________。
②过滤后的物质用含乙醇的洗涤液洗涤,原因是_________________。
③准确称取0.25gCuCl样品置于一定量的FeCl3溶液中,待样品完全溶解后,加水至20mL,用0.050mol/L的K2Cr2O7标准溶液滴定至终点,消耗8.12mLK2Cr2O7溶液,则该样品中CuCl的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 含有最高价元素的化合物一定具有强氧化性
B. 失电子越多的还原剂,其还原性就越强
C. 阳离子只能得电子被还原,作氧化剂
D. “A氧化B”与“B被A氧化”,“A被B还原”表达的含义相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月17日,广东警方查获黑窝点非法使用Na2S2O4等浸泡食物来达到保鲜作用,Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)
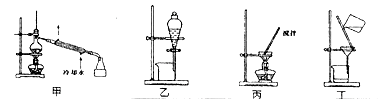
装置如图所示:

(1)A装置中的分液漏斗改为 (仪器名称)更合适,D中盛放的试剂为 。
(2)B装置的作用为 ;
(3)C装置内发生的化学反应方程式为 。
(4)分离C装置中产品时就选用下列装置 (填甲、乙、丙、丁,下同),回收乙醇的装置为 。
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com