
【题目】铁、铝在生产生活中有广泛的应用。回答下列问题:
(1)铝的原子结构示意图为___。它位于元素周期表的第___周期,第___族。
(2)除去铁粉中混有的少量铝粉,可以加入足量的___溶液,充分反应后过滤、洗涤、烘干,反应的化学方程式为___。
(3)实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为___。
(4)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为___。
(5)检验某溶液中是否含有Fe3+的操作方法是___。
【答案】![]() 3 ⅢA NaOH溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al3++3NH3H2O=Al(OH)3↓+3NH
3 ⅢA NaOH溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al3++3NH3H2O=Al(OH)3↓+3NH![]() 3Fe+4H2O(g)
3Fe+4H2O(g)![]() Fe3O4+4H2 取样,滴入几滴KSCN溶液,若溶液变红色说明有Fe3+,反之则无
Fe3O4+4H2 取样,滴入几滴KSCN溶液,若溶液变红色说明有Fe3+,反之则无
【解析】
(1)铝是13号元素,有3个电子层,分别排布2、8、3个电子,原子结构示意图为![]() 。根据铝的原子结构示意图可知,它位于元素周期表的第3周期第ⅢA族;
。根据铝的原子结构示意图可知,它位于元素周期表的第3周期第ⅢA族;
(2)铝与NaOH溶液反应而铁与NaOH溶液不反应,除去铁粉中混有的少量铝粉,可以加入足量的NaOH溶液,充分反应后过滤、洗涤、烘干,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)因氢氧化铝可与强碱溶液反应,则实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH![]() ;
;
(4)常温下,铁与水不反应,但红热的铁会和水蒸气发生反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(5)根据铁离子遇KSCN得红色溶液,检验某溶液中是否含有Fe3+的操作方法是取样,滴入几滴KSCN溶液,若溶液变红色说明有Fe3+,反之则无。


科目:高中化学 来源: 题型:
【题目】已知:R—CH=CH2+HX![]() ,A、B、C、D、E有如图转化关系:
,A、B、C、D、E有如图转化关系:
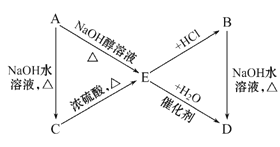
其中A、B分别是化学式为C3H7Cl的两种同分异构体。根据图中各物质的转化关系填写。
(1)写出物质结构简式:A___、C__、D__、E___。
(2)完成下列反应的化学方程式:
①A→C___;
②E→D___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图转化关系所示(部分反应物略去):组成单质丁的元素存在三种核素,其中一种核素没有中子。三种核素中质量数最大的原子可表示为__________

(1)由组成单质丁的元素与另一种元素形成的三核 10电子微粒所构成的物质的用途__________________________
(2)乙为 NaOH,若戊为不溶于强酸,但溶于强碱的沉淀物,则甲乙反应时作氧化剂的是__________________
(3)丙→戊反应的化学方程式为_______________________
(4)若戊为既能溶于强酸又能溶于强碱的沉淀物,则甲和乙反应的离子方程式为____________________
II.A、B、C、D 是原子序数依次增大的五种短周期主族元素,其中 A 的原子序数是 B 和 D 原子序数之和的 1/4,C 元素的单质能在A 元素最高价氧化物中燃烧,甲和丙是 D 元素的两种常见氧化物,乙和丁是 B 元素的两种常见同素异形体,1 L 0.005mol·L-1 戊溶液中含 H+ 0.01mol。它们之间的转化关系仍如上图所示(部分反应物省略),
(5)B、C 的元素符号分别是____________________、___________________________其甲和乙反应生成丙和丁的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,错误的是 ( )
A.配制 5%食盐溶液时,称量 5g 食盐放入烧杯中加入 95g 水搅拌溶解
B.胆矾晶体结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知 NaOH 溶液浓度时,红色手柄滴定管需用标准酸液润洗 2﹣3 次
D.配制 0.1 mol/L 的 H2SO4 溶液时,将量取的浓 H2SO4 放入容量瓶中加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 的
的![]() ,
,![]() ,室温下向10mL
,室温下向10mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象![]() 因有逸出未画出
因有逸出未画出![]() 。下列说法错误的是
。下列说法错误的是![]()
A.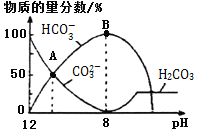
A点所示溶液的![]()
B.B点所示溶液:![]()
C.A点![]() 点发生反应的离子方程式为
点发生反应的离子方程式为![]()
D.Na2CO3溶液中,c(Na+)+c(H+)=2C(CO32-)+c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:
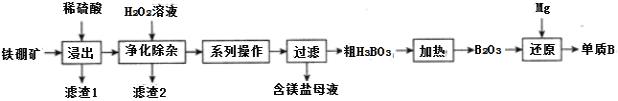
已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定![]() 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.  水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.  CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com