
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子最外层电子数为次外层电子数的3倍。E与D位于同一主族。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体。
回答下列问题:
(1) 基态E原子的价电子排布图为_____________________。
(2) 形成化合物Y的五种元素中第一电离能最大的是__________;电负性最大的是________(填元素符号)。
(3) 化合物X中心原子的杂化方式为________,X分子中的两种键角的大小关系是_________________(用∠XYZ表示,X、Y、Z代表元素符号)。
(4) C2D分子的立体结构为________________;A分别与B、C形成的简单化合物熔、沸点由高到低顺序为________(用化学式表示),简单说明原因_________________。
(5) 晶体Y中存在的化学键类型有_____________________。(填代号)
A、离子键 B、非极性共价键 C、配位键 D、氢键 E、σ键 F、金属键
(6) 下图是D、F两种元素形成的化合物的晶胞结构示意图,F的配位数是_______________;已知晶胞中最近的两个D原子间距离为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)。

【答案】 ![]() N O sp2杂化 ∠OCH大于∠HCH 直线形 NH3>CH4 NH3分子间存在氢键 ACE 2
N O sp2杂化 ∠OCH大于∠HCH 直线形 NH3>CH4 NH3分子间存在氢键 ACE 2 ![]()
【解析】已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,B是C。D原子最外层电子数为次外层电子数的3倍,D是O,所以C是N。E与D位于同一主族,E是S。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体,X是甲醛,因此A是H。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体,所以F是Cu;则
(1) 基态S原子的核外电子数是16,则价电子排布图为![]() 。(2)由于氮元素的2p轨道电子处于半充满状态,稳定性强,则形成化合物Y的五种元素中第一电离能最大的是N;非金属性越强,电负性越大,则电负性最大的是O。(3)HCHO是平面形结构,则中心原子碳原子的杂化方式为sp2杂化,HCHO分子中由于氧原子上有2对未成键的孤电子对,且为C=O双键,均对C-H键或C-Cl键形成较大的斥力,故HCHO分子中的两种键角的大小关系是∠OCH大于∠HCH。(4) N2O分子和CO2互为等电子体,则立体结构为直线形;由于NH3分子间存在氢键,所以沸点:NH3>CH4。(5) 晶体Y的化学式为[Cu(NH3)4]SO4·H2O,其中存在的化学键类型有离子键、配位键、σ键,答案选ACE;(6)根据晶胞结构可知Cu的配位数是2;已知晶胞中最近的两个O原子间距离为a nm,则晶胞的体对角线是2a nm,晶胞的边长是
。(2)由于氮元素的2p轨道电子处于半充满状态,稳定性强,则形成化合物Y的五种元素中第一电离能最大的是N;非金属性越强,电负性越大,则电负性最大的是O。(3)HCHO是平面形结构,则中心原子碳原子的杂化方式为sp2杂化,HCHO分子中由于氧原子上有2对未成键的孤电子对,且为C=O双键,均对C-H键或C-Cl键形成较大的斥力,故HCHO分子中的两种键角的大小关系是∠OCH大于∠HCH。(4) N2O分子和CO2互为等电子体,则立体结构为直线形;由于NH3分子间存在氢键,所以沸点:NH3>CH4。(5) 晶体Y的化学式为[Cu(NH3)4]SO4·H2O,其中存在的化学键类型有离子键、配位键、σ键,答案选ACE;(6)根据晶胞结构可知Cu的配位数是2;已知晶胞中最近的两个O原子间距离为a nm,则晶胞的体对角线是2a nm,晶胞的边长是![]() ,密度是(
,密度是(![]() ×10-7cm)3,则该晶体的密度为
×10-7cm)3,则该晶体的密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】碘元素是一种有多种化合价的非金属元素。
(1)足量的碘与56 g铁充分反应,转移的电子数为 NA;反应KIO4+8HI![]() 4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
(2)在一支试管中按某顺序加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液D.稀H2SO4 E.H2O2溶液
发现溶液颜色有如下变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。则加入药品的顺序是(写序号) ,③→④反应的化学方程式为 。
(3)工业上制得的粗碘中通常含卤素互化物ICl、IBr,受热时ICl和IBr均可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是 。
a.KBr b.KCl c.KI d.Zn
(4)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是 。
(5)医药工业的重要原料高碘酸钠可采用氯气氧化法制备。工艺流程如图:
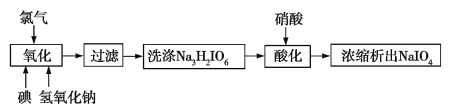
写出氧化过程中发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功研制出一种全新的铝—石墨双离子电池(AGDIB)。这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi + Cx(PF6)![]() LiPF6 + xC + Al。
LiPF6 + xC + Al。
下列关于该电池的说法不正确的是
A. 该电池不能用水溶液作为电解质
B. 放电时,Li+在电解质中由负极向正极迁移
C. 充电时,若转移1 mol e—,阴极电极将增重7g
D. 放电时,正极的电极反应式为AlLi-e-=Li+ + Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,能观察到明显现象的是( )
A. 在稀盐酸中滴加NaOH溶液
B. 在AlCl3溶液中滴加NaOH溶液
C. 在NaHCO3溶液中滴加NaCl溶液
D. 在FeCl2溶液中滴加少量H2O2后,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的本质是金属与其接触的其他物质在一定条件下发生氧化还原反应而受到损害。下列不属于化学或电化学防腐方法的是( )
A. 在金属表面涂刷一层油漆
B. 利用电镀技术在金属表面镀上一层其他金属
C. 用阳极氧化处理使铝表面形成致密的氧化物膜
D. 利用特殊工艺在钢铁表面生成一层致密的Fe3O4薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A. 非金属单质燃烧时火焰均为无色
B. 所有金属及其化合物灼烧时火焰均有颜色
C. 焰色反应均应透过蓝色钴玻璃观察
D. NaCl与Na2CO3灼烧时火焰颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的 “理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A. 采用多孔电极的目的是提髙电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D. 在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com