
| A�� | �þƾ���������������������ۻ��������䣬˵��Al2O3��Al | |
| B�� | ��¯ˮ��CaSO4����Na2CO3��Һ���ݣ��������ܽ�ȥ����˵��Ksp��CaCO3��CaSO4 | |
| C�� | ��Na2SiO3��Һ��ͨ������CO2���壬�а�ɫ�������ɣ�˵�����ԣ�H2CO3��H2SiO3 | |
| D�� | ������ͨ��������Һʱ������һ�������ġ�ͨ·����˵����ɢ������ֱ����1-100nm֮�� |
���� A�����������۵�ߣ�������Al�����棬���������ۻ��������䣻
B��������Խ���ܣ����ܶȻ�ԽС��
C������ǿ����ȡ����ԭ��������
D��������Ϊ�����ЧӦ��˵���÷�ɢϵΪ���壮
��� �⣺A����һƬ�������ھƾ����������������������������������۵�ߣ�������Al�����棬�������ۻ��������䣬��A��ȷ��
B����¯ˮ��CaSO4����Na2CO3��Һ���ݣ��������ܽ�ȥ����˵��̼��Ƹ����ܣ�˵��Ksp��CaCO3��CaSO4����B����
C����Na2SiO3��Һ��ͨ������CO2���壬�а�ɫ�������ɣ����ɰ�ɫ����Ϊ���ᣬ��˵������H2CO3��H2SiO3����C��ȷ��
D��������ͨ��������Һʱ������һ�������ġ�ͨ·����������Ϊ�����ЧӦ��˵���÷�ɢϵΪ���壬���ɢ������ֱ����1-100nm֮�䣬��D��ȷ��
��ѡB��
���� ���⿼���˻�ѧʵ�鷽�������ۣ���Ŀ�ѶȲ����漰�����仯�������ʡ��������ܽ�ƽ�⼰����ת��ʵ�ʡ��������ʡ�����ǿ���Ƚϵ�֪ʶ����ȷ����Ԫ�ؼ��仯�������ʼ��ɽ������������ѧ���ķ������������Ӧ��������


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������HCl��Cl2ͨ�뱥��NaHCO3��Һ�г�ȥHCl | |
| B�� | �ó���ʯ��ˮ����NaHCO3��Na2CO3 | |
| C�� | ��BaCl2��Һ����SO42-��SO32- | |
| D�� | ��ŨHNO3��Cu��Ӧ�Ʊ�NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ������ĸ001A�Ƚ�ͧ�Ĵ���Ϳ�к�Cu2O�ķ���Ϳ�ϣ��Ʊ�Cu2O��һ�ַ���Ϊ��
������ĸ001A�Ƚ�ͧ�Ĵ���Ϳ�к�Cu2O�ķ���Ϳ�ϣ��Ʊ�Cu2O��һ�ַ���Ϊ��| A�� | Zn�õ����� | B�� | CuSO4������ | C�� | NaOH�ǻ�ԭ�� | D�� | CuSO4�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Aװ��ʵ��˵�� Ksp��AgCl����Ksp��Ag2S�� | B���Ʊ�Fe��OH��2���� | C������ȡ��ˮ�е�I2���ֳ�ˮ���IJ��� | D����¼�ζ��յ���� Ϊ12.20mL |
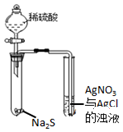 | 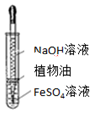 | 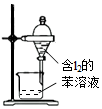 | 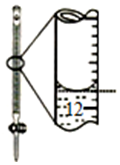 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ҹ����Һ�ĸ�����������������ػ�����������������ָ��£����ڽ������� | |
| B�� | ���Ƹ����ܵ���ĥ��̥���ɼ���PM2.5�ȿ�����IJ��� | |
| C�� | ��������TiO2�ⴥý��������װ�������ͷŵ�HCHOת��Ϊ������ | |
| D�� | �ߴ��ȵĹ赥�ʹ㷺���ڹ��ά�����ά��ǿ�����ɡ���·�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �������ç������ijЩ�ߵ�ֲ�����е�֬��״�л� �᳣������һ����ṹ��ʽ��ͼ��ʾ������˵����ȷ���ǣ�������
�������ç������ijЩ�ߵ�ֲ�����е�֬��״�л� �᳣������һ����ṹ��ʽ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��������ç���ụΪͬ���칹�� | |
| B�� | �����Ậ�еĹ�������ȫ��ͬ | |
| C�� | ��������ܷ����ӳɷ�Ӧ���ۺϷ�Ӧ��ȡ����Ӧ | |
| D�� | �����ʵ����Ŀ������ç����ֱ�������Na��Ӧ��ͬ��ͬѹ�²���H2�������Ϊ5��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
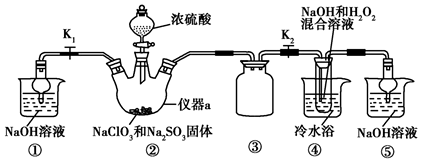
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
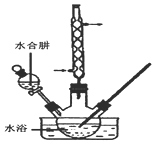 �⻯����һ�ְ�ɫ�ᾧ��ĩ��ҽ���Ͽ����ڼ�״���������μ�����̵���ȣ�ʵ������NaOH�����ʵ��ˮ����Ϊԭ���Ƶã�����װ����ͼ��ʾ��
�⻯����һ�ְ�ɫ�ᾧ��ĩ��ҽ���Ͽ����ڼ�״���������μ�����̵���ȣ�ʵ������NaOH�����ʵ��ˮ����Ϊԭ���Ƶã�����װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l������H=-57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų����ȵ���57.3kJ | |
| B�� | ��һ�ܱ������з�����Ӧ2SO2+O2?2SO3������ѹǿ��ƽ�������ƶ���K���� | |
| C�� | 2C��s��+O2��g���T2CO��g����H=-221 kJ•mol-1����C��ȼ���ȡ�H=-110.5 kJ•mol-1 | |
| D�� | ��ϡ�����м�����������ͭ�����п��ϡ���ᷴӦ�������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com