
| ʵ����� | ������Һ | ��ȩ����/�� | ˮԡ�¶�/�� | ��Ӧ���Һ��pH | ��������ʱ�� |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
���� ��1���Ա�ʵ�飺ʵ��1��ʵ��3�ķ�Ӧ����������������ͬ��ֻ����ȩ��������ͬ����ʵ��Ŀ���ǣ��Ƚ�������Ӧ�У���ȩ������ͬ������������Ӱ�죻
��2������������ͬ�������¶����ߣ���Ӧ���ʼӿ죺����������ͬ���¶�Ϊ40��ʱ�ķ�Ӧ����Ӧ�����¶�Ϊ30���¶�Ϊ45��֮�䣻
��3��Ҫ��̽��������Һ�������Գ�������������Ӱ�죬��ƶԱ�ʵ�飻
��4�������к������������ۣ��������ϡ�����ȥ��Ȼ���ù��˵ķ����õ����������ۣ��ڹ�������ϴ�ӳ�����ʹ����ˮ��û������ˮ��Ȼ���£��Դ������
��5���������͵������Һ����ԭ��أ�����������������������������ʧ���ӷ���������Ӧ�������������ӵõ��ӷ�����ԭ��Ӧ���ݴ˷������
��� �⣺��1���Ա�ʵ��1��ʵ��3�ķ�Ӧ����������������ͬ��ֻ����ȩ��������ͬ����ʵ��Ŀ���ǣ��Ƚ�������Ӧ�У���ȩ������ͬ������������Ӱ�죬
�ʴ�Ϊ���Ƚ���ȩ������ͬ������������ʱ�䣨�ٶȻ��������ɣ���
��2����ʵ��2��ʵ��4֪��������Һ����Ϊ1mL����ȩ����Ϊ3�Σ���Ӧ���ҺpHΪ1ʱ��ˮԡ�¶�Ϊ45�棬��������ʱ��Ϊ6.5min��ˮԡ�¶�Ϊ30�棬��������ʱ��Ϊ9min������������ͬ�������¶����ߣ���Ӧ���ʼӿ죬�ʣ���������Һ����Ϊ1mL����ȩ����Ϊ3�Σ�ˮԡ�¶�Ϊ40�棬��Ӧ���ҺpHΪ11ʱ������������ʱ��Ӧ��6.5min��9min֮�䣻������Ӧʵ��������������ʵ���������������ȵطֲ����Թܱ��ϣ��γɹ����������������Ĺ����̶��뷴Ӧ�����йأ�
�ʴ�Ϊ����6.5��9min֮�䣻
��3��Ҫ��̽��������Һ�������Գ�������������Ӱ�죬����ƶԱ�ʵ�飺������Һ��������ͬ��������ȩ������ˮҺ�¶ȡ���Ӧ���Һ��PH��ͬ�������Ƚ�����������ʱ�䣬�ʴ�Ϊ��������Һ��������ͬ��pH��ͬ��
��4����Ag2S�����۷ŵ��ձ��м�Ũ���������У�ʹAg2S������ۣ���Ӧ�Ļ�ѧ����ʽΪ��Ag2S+Fe+2HCl$\frac{\underline{\;\;��\;\;}}{\;}$2Ag+FeCl2+H2S����Ȼ���ù��˵ķ����õ����������ۣ����ò�������Ϊ���ձ���©�������������ڹ�������ϴ�ӳ����IJ��������Ų������������ע������ˮ��û������ˮ��Ȼ���£��ظ�2��3�Σ�
�ʴ�Ϊ��Ag2S+Fe+2HCl$\frac{\underline{\;\;��\;\;}}{\;}$2Ag+FeCl2+H2S����b e f�����Ų������������ע������ˮ��û������ˮ��Ȼ���£��ظ�2��3�Σ�
��5���������������������У��������Ļ����Դ�����������Ϊ������ʧ���ӣ���Ϊ�������ʴ�Ϊ������
�������������м���ʳ����Һ���ٽ���ڵ�����������ΪAg2S�������Һ�У����ܻ�ԭ������ͬ�������������������⣬��Ӧ�ķ���ʽΪ2Al+3Ag2S+3H2O=2Al��OH��3+6Ag+3H2S�����ʴ�Ϊ��2Al+3Ag2S+3H2O=2Al��OH��3+6Ag+3H2S����
���� ���⿼�����������ʵĶԱ�������̷����жϣ�������Ʒ�����ע�����⣬�Ա�ʵ�顢������Ӧ��ʵ���������������Է�Ӧ���ʵ�Ӱ�죬���ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳƷ���г����й轺�����ۣ�������������� | |
| B�� | ����ʵʩ����ȼ�����������������ܼ�������������ŷ� | |
| C�� | ������ˮʱ�����˻�ѧ�������仯������ˮ���ã���û��ɱ�������������� | |
| D�� | ij���ͺ����������Ҫ�ɷ�����̼���衢�մɺ�̼��ά���϶��ɣ�����һ���������ǽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
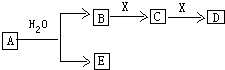
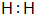 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǽ���Ԫ�س��ֵ���ͻ��ϼۣ������ֵ���ڸ�Ԫ��ԭ�ӵ����������� | |
| B�� | �ǽ���Ԫ�س��ֵ�����ϼ۲�������Ԫ��ԭ�ӵ����������� | |
| C�� | �������2�����ӵ�ԭ�Ӷ��ǽ���ԭ�� | |
| D�� | ����Ԫ��ֻ�����ۺ���ۣ����ǽ���Ԫ�ؼ����������и���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
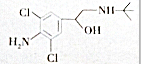
| A�� | �����ʺ��б��������ڷ����廯���� | |
| B�� | ������ֻ����-OH��-NH2���ֹ����� | |
| C�� | �����ʺ���-OH���;���-OH������ | |
| D�� | �������ܷ���������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ���ø����ܶȴ����Ҵ��Ҹ�������ˮ�����и������Ҵ��Ļ������� | |
| B�� | 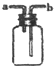 ����H2��NH3��CO2��Cl2��HCl��NO2�������ռ���Ҳ������NO�����ռ� | |
| C�� |  ��Xѡ�ñ�ʱ�ɽ���NH3��HCl�����գ�����ֹ���� | |
| D�� | 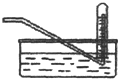 ������ʵ�����ռ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��OH-��HCO3- | B�� | Ag+��Fe3+��Cl- | C�� | NH4+��K+��OH- | D�� | Ba2+��OH-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| 2min | 4min | 6min | 8min | ���� | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ���� |
| H2 | x | 0.12 | 0.12 | 0.2 | ���� |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com