
【题目】已知下列反应:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣266kJ/mol
O2(g)△H=﹣266kJ/mol
试回答:
(1)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为: .
(2)沼气是一种能源,它主要成分是CH4 . 0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,则其燃烧的热化学方程式为: .
(3)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l),已知室温下3.2gSiH4自燃放出热量79.2kJ,其热化学方程式为: .
【答案】
(1)CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ?moL﹣1
(3)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol
【解析】解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣266kJ/mol,
O2(g)△H=﹣266kJ/mol,
由盖斯定律: ![]() ×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H=
×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H= ![]() ×(﹣566)+(﹣266)=﹣549 kJ/mol,
×(﹣566)+(﹣266)=﹣549 kJ/mol,
所以答案是:CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol;
(2)0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,所以1mol甲烷完全燃烧生成液态水时能放出890kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJmoL﹣1,
所以答案是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJmoL﹣1;
(3)n(SiH4)= ![]() =0.1mol,则1molSiH4燃烧放出的热量为:792kJ,
=0.1mol,则1molSiH4燃烧放出的热量为:792kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol,
所以答案是:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数.下列说法正确的是( )
A.标准状况下,22.4 L 苯中含有的苯分子数是NA
B.标准状况下,1mol氦气中含有的核外电子数为4NA
C.常温常压下,15g乙烷分子中含有的碳氢键数目为3 NA
D.常温常压下,0.10 molL﹣1CH3COOH溶液中含有的H+数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示:下列有关该有机物的叙述正确的是( )

A.该有机物的分子式为C11H14O3
B.该有机物可能易溶于水且具有水果香味
C.该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代
D.1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图 ![]() 为直流电源,
为直流电源, ![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, ![]() 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 ![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 ![]() 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )
A.a为直流电源的负极
B.c极发生的反应为2H++2e═﹣H2↑
C.f电极为锌板
D.e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:3SiCl4 +2N2 +6H2![]() Si3N4 +12HCl。
Si3N4 +12HCl。
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于_____________晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是______________(填写元素符号);属于非极性分子的化合物的电子式是__________。
(2)比较Si和Cl两种元素非金属性强弱的方法是__________。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为_________________(简述理由),写出Si与强碱溶液反应的离子反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:
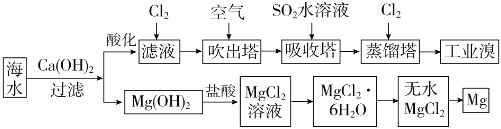
(1)提取溴的过程中,经过2次![]() 转化的目的是__________,吸收塔中发生反应的离子方程式是
转化的目的是__________,吸收塔中发生反应的离子方程式是![]() ,蒸馏塔中发生反应的离子方程式是____________。
,蒸馏塔中发生反应的离子方程式是____________。
(2)从![]() 溶液中得到
溶液中得到![]() 晶体的主要操作是__________、_________、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是__________。
晶体的主要操作是__________、_________、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是__________。
(3)据上述流程,将![]() 海水中溴元素(海水中
海水中溴元素(海水中![]() 离子含量为
离子含量为![]() )转化为工业溴,整个流程中至少需要标准状况下
)转化为工业溴,整个流程中至少需要标准状况下![]() 的体积为_________L(忽略
的体积为_________L(忽略![]() 溶解)。
溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是 ( )
A. 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后分子总数为0.5 NA
B. 标准状况下,11.2 L水含有的电子总数为9 NA
C. 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA![]()
D. 1 mol C5H12(戊烷)中含有共价健16 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A.化学键都具有饱和性和方向性
B.晶体中只要有阴离子,就一定有阳离子
C.氢键具有方向性和饱和性,也属于一种化学键
D.金属键由于无法描述其键长、键角,故不属于化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
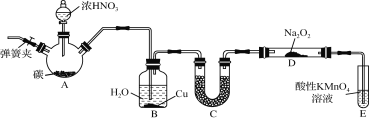
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com