
| 第一电离能 | 氧化性 | 沸点 | 非金属性 |
| N>S | Fe3+>Al3+ | NH3<H2O | 16O=18O |
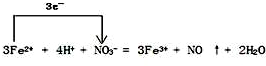 .
. 分析 (1)S是16号元素,位于元素周期表第三周期第VIA族,Fe是26号元素,其的基态原子核外价电子排布式为 3d64s2;O的基态原子核外有8个电子,所以有8种运动状态不同的电子;
(2)氮的外围达半满的稳定结构,所以第一电离能大于硫的第一电离能,金属性越强对离子的氧化性越弱;水在100度下才会沸腾,由液态转变为气态,而氨气在常温状态下就为气态;同位素的化学性质相似;
(3)根据盖斯定律分析解答;
(4)FeSO4溶液中的亚铁离子具有还原性与硝酸具有强氧化性,发生氧化还原反应.
解答 解;(1)S是16号元素,位于元素周期表第三周期第VIA族,Fe是26号元素,其的基态原子核外价电子排布式为 3d64s2;O的基态原子核外有8个电子,所以有8 种运动状态不同的电子,故答案为:三;VIA;3d64s2(或1s22s22p63s23p63d64s2);8;
(2)氮的外围达半满的稳定结构,所以第一电离能大于硫的第一电离能所以氮的第一电离能大于硫,铝的金属性越强于铁,所以铁离子的氧化性强于铝离子;水在100度下才会沸腾,由液态转变为气态,而氨气在常温状态下就为气态,所以水的沸点高于氨;同位素的化学性质相似,所以两者非金属性相同,
故答案为:>;>;<;=;
(3)4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol…①
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol…②
则$\frac{②-①}{2}$为:Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1,
故答案为:Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1;
(4)FeSO4溶液中的亚铁离子具有还原性与硝酸具有强氧化性,发生氧化还原反应,所以电子转移的方向和数目为: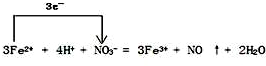 ,故答案为:
,故答案为: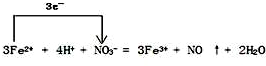 .
.
点评 本题考查元素在周期表中位置、核外价电子排布、微粒的性质、以及盖斯定律的应用和氧化还原反应的相关知识,综合性强,但比较容易.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:多选题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为3.0 mol/L | |
| B. | 当混合物质量为9.2 g时,50 mL盐酸恰好完全反应 | |
| C. | 混合物中NaHCO3、KHCO3的物质的量之比为1:2 | |
| D. | 混合物中NaHCO3的质量分数为45.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③⑤⑥ | C. | ①②④⑦ | D. | ②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:W>Z>Y>X | |
| B. | W氢化物的沸点比X氢化物的沸点高 | |
| C. | Y元素的周期序数等于主族序数 | |
| D. | Y、Z两元素的最高价氧化物对应的水化物能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O.
+NaBr+H2O. .
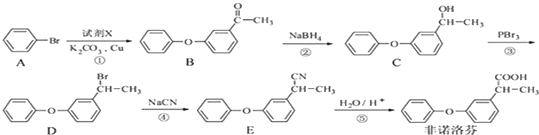
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
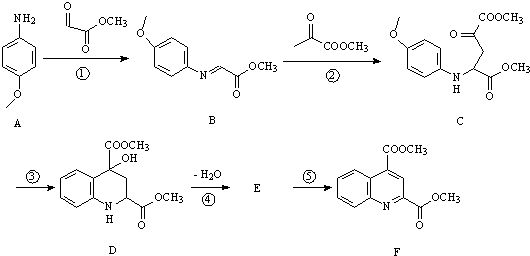

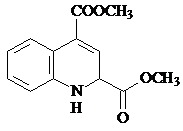 .
. 或
或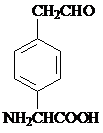 .
.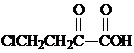 和苯、乙醇为原料,可合成
和苯、乙醇为原料,可合成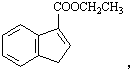 ,写出合成流程
,写出合成流程
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

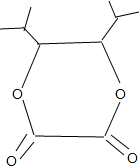 +2H2O;
+2H2O; ;
;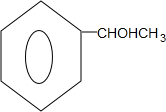 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com