
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体
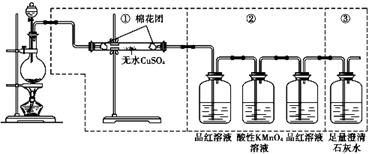 |
(1)如果装置中①.②.③三 部分仪器的连接顺序改为②.①.③,则可以检验出的物
质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变
为①.③.②,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②.③.①,则可以检出的物质是 ;不能检出的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
你认为减少酸雨产生的途径可采取的措施是 ( )。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加
熟石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
工业接触法制硫酸的简单流程图如下:
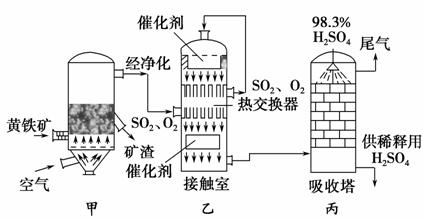
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是____________________________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是________________________________________________,
________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国UNC化学教授Thomas J.Meyer等研发了环境友好、完全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10 mL Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为 ( )
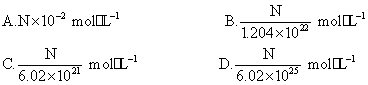
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
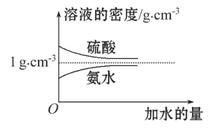
| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度 /g·cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与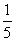 c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度
c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度 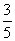 c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
|
| B. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
|
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
|
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com