
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)③的气态氢化物的电子式 .
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式、 .
(5)单质①在单质⑧中燃烧,火焰为色.
【答案】
(1)Na>Al>O
(2)HClO4>H2CO3>H2SiO3
(3)![]()
(4)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(5)苍白
【解析】解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,所以答案是:Na>Al>O;(2)非金属性Cl>C>Si,则最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3 , 所以答案是:HClO4>H2CO3>H2SiO3;(3)③的气态氢化物为氨气,其电子数为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;氯气与NaOH溶液反应生成氯化钠、次氯酸钠,离子反应为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O; 所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(5)单质①在单质⑧中燃烧,生成HCl,火焰为苍白色,所以答案是:苍白.
;(4)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;氯气与NaOH溶液反应生成氯化钠、次氯酸钠,离子反应为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O; 所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(5)单质①在单质⑧中燃烧,生成HCl,火焰为苍白色,所以答案是:苍白.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式
(1)碳酸钙与稀盐酸混合 ______________________________。
(2)铝与氢氧化钠溶液反应 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.活化分子碰撞即发生化学反应
B.升高温度会加快反应速率,其主要原因是增加了活化分子碰撞的次数
C.有气体参加的化学反应,若增大压强,可增大活化分子百分数,从而使反应速率增大
D.活化分子间的碰撞不一定是有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
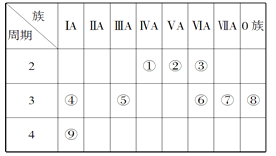
(1)在这些元素中,化学性质最不活泼的是________(填元素符号),②位于元素周期表的第____纵行。
(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大为___________________。(用序号表示)
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为__________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同
B.③的简单氢化物比⑥的简单氢化物稳定
C.③的简单氢化物的沸点比⑥的简单氢化物的沸点高
D.③的单质能与⑥的简单氢化物反应生成⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置、选用的试剂或实验操作中,都正确的是( )
A. 实验室用装置制取氨气
实验室用装置制取氨气
B.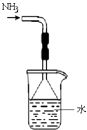 用装置吸收氨气,并防止倒吸
用装置吸收氨气,并防止倒吸
C.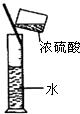 用装置稀释浓硫酸
用装置稀释浓硫酸
D. 用装置除去CO2中的HCl
用装置除去CO2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,气体全部逸出后,向溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol/L.(结果须化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于热化学方程式的是( )
A.CaCO3→CaO + CO2-1185kJB.CaCO3(s)→CaO(s)+CO2(g)
C.CaCO3(s) →CaO(s)+CO2(g)-1185kJD.CaCO3→CaO+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com