
| A. | 0.3mol | B. | 小于0.15mol | C. | 0.15~0.3mol | D. | 0.15mol |
分析 发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,n(HCl)=12mol/L×0.05L=0.6mol,随反应进行,浓盐酸变为稀盐酸,稀盐酸与二氧化锰不反应,以此来解答.
解答 解:n(HCl)=12mol/L×0.05L=0.6mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,若盐酸完全反应,生成Cl2的物质的量为$\frac{0.6mol}{4}$=0.15mol,但随反应进行,浓盐酸变为稀盐酸,稀盐酸与二氧化锰不反应,则制得的Cl2的物质的量小于0.15mol,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应与物质的量关系为解答的关键,侧重分析与计算能力的考查,注意稀盐酸与二氧化锰不反应,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸可以洗去锅炉水垢 | |
| B. | 用加热的方法可以杀死流感病毒 | |
| C. | 食盐既可做调味品,也可以做防腐剂 | |
| D. | 洗涤棉制品可以使用弱碱性洗涤剂或肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
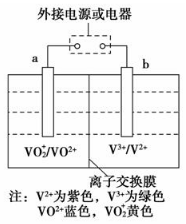 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )| A. | 放电时,H+从左槽迁移进右槽 | |
| B. | 放电过程中,左槽溶液颜色由黄色变为蓝色 | |
| C. | 充电时,b极接直流电源正极,a极接直流电源负极 | |
| D. | 充电过程中,a极的电极反应式为:VO2++2H++e-═VO2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度溶液时,若加水超容最瓶刻度应用胶头滴管将多余溶液吸出 | |
| B. | 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大 | |
| C. | 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中 | |
| D. | 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 分子间作用力越大,物质的熔、沸点越高 | |
| C. | 相对分子质量越大,其分子间作用力越大 | |
| D. | 分子间只存在范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:正己烷>3-甲基戊烷>2-甲基丁烷 | |
| B. | 含氢量:乙烯>乙苯>乙炔 | |
| C. | 密度:苯>H2O>CCl4 | |
| D. | 相同质量的物质含共用电子对总数:乙烷>乙烯>乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
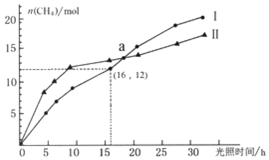 可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )
可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好 | |
| B. | 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多 | |
| C. | a点时,CO2的转化率相等 | |
| D. | 0-16h内,v(O2)=1.5mol/(L•h) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com