
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
分析 (1)加入氢氧化钠除去镁离子,再加入氯化钡除去硫酸根离子,然后加入碳酸钠除去钡离子和钙离子,由此分析滤渣的组成;
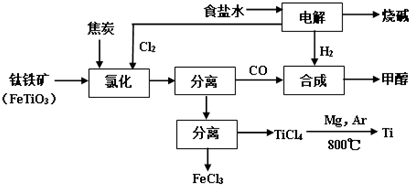
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式;
(3)氯碱工业中的产物高效利用,大大提高资源利用率,降低生产成本,有毒气体一氧化碳的利用,减少了环境污染;合成甲醇的主反应为:CO+2H2?CH3OH+Q;
同时有副反应如:8CO+17H2?C8H18+8H2O+Q;4CO+8H2?C4H9OH+3H2O+Q,结合流程图分析解答;
(4)根据图中流程可知,利用CO和H2,反应生成甲醇,根据所需要的氢气总量减去电解生成总量,计算额外所需氢气的量;
(5)应用两种氯化物有沸点不同,应用蒸馏的方法分离.
解答 解:(1)加入氢氧化钠除去镁离子,生成氢氧化镁,再加入氯化钡除去硫酸根离子,生成硫酸钡沉淀,然后加入碳酸钠除去钡离子和钙离子,生成碳酸钡和碳酸钙,故答案为:BaSO4、CaCO3、BaCO3、Mg(OH)2;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2 $\frac{\underline{\;通电\;}}{\;}$2TiCl4+2FeCl3+6CO,故答案为:2FeTiO3+6C+7Cl2 $\frac{\underline{\;通电\;}}{\;}$2TiCl4+2FeCl3+6CO;
(3)氯碱工业中的产物高效利用,大大提高资源利用率,降低生产成本,有毒气体一氧化碳的利用,减少了环境污染,合成甲醇的主反应为:CO+2H2?CH3OH+Q;
同时有副反应如:8CO+17H2?C8H18+8H2O+Q;4CO+8H2?C4H9OH+3H2O+Q,所以还能得到副产品是C8H18、C4H9OH、FeCl3、MgCl2,故答案为:大大提高资源利用率;降低生产成本;减少环境污染等;C8H18、C4H9OH、FeCl3、MgCl2;
(4)根据CO+2H2→CH3OH,CH3OH~CO~$\frac{7}{6}$Cl2~$\frac{7}{6}$H2,所以生产1 molCH3OH,理论上还需补充氢气(2-$\frac{7}{6}$))mol=$\frac{5}{6}$mol,即$\frac{5}{3}$gH2,故生产192 t CH3OH还需补充H2的质量10t,故答案为:10;
(5)应用两种氯化物有沸点不同,应用蒸馏的方法分离,具体操作将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分,故答案为:将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分.
点评 本题考查较为综合,涉及化学方程式的书写及计算、物质的分离等,题目难度中等,注意两种沸点不同物质的分离与提纯.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | NO3-、BF3、N2O | B. | SO3、CO2、NO2 | C. | CO、N2、CN- | D. | CO2、SCN-、NO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 它的热稳定性好 | ||
| C. | 它能与强碱发生反应 | D. | 其溶液可与AgNO3溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3周期ⅥA族 | B. | 第3周期ⅥB族 | C. | 第3周期ⅣB族 | D. | 第3周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(Na+):n(Cl-)可能为7:3 | |
| B. | 与NaOH反应的氯气一定为0.3mol | |
| C. | 当转移电子为n mol时,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为6:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com