
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:
【题目】第ⅢA族硼、稼及其化合物在材料科学领域有广泛应用。
(1)基态硼原子电子排布图为___。
(2)常温下,Ga(CH3)3呈液态。在高温条件下,Ga(CH3)3和AsH3反应可制备半导体材料GaAs和另一产物为M,
①M是__分子(填“极性”或“非极性”);Ga(CH3)3中Ga原子和C原子构成的空间构型是__。
②Ga(CH3)3的晶体类型是__晶体;B、Ga和As均属于__区元素(填字母)。
A.s B.p C.d D.ds
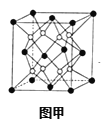
(3)硼酸(H3BO3)是层状结构晶体(如图甲所示),在冷水中溶解度很小,加热时溶解度增大。
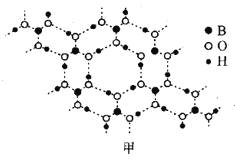
①硼酸晶体中存在的作用力有__(填字母)。
a.σ键极 b.π键 c.氢键 d.范德华力
②硼酸在水中溶解度随着温度升高而增大的主要原因可能是__。
(4)NaBH4、LiBH4常作有机合成的还原剂,其中B原子的杂化轨道类型是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞如图乙所示。已知:P-B键键长为Rnm,NA是阿伏加德罗常数的值。
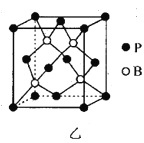
①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为___nm。
②BP晶体密度为__g·cm-3(用含R和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).
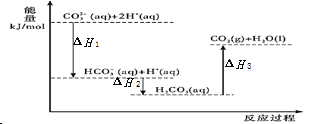
A.△H1 >△H2 ; △H2<△H3
B.反应 ![]() (aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
(aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
C.![]() (aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3 变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的p能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为__,其基态原子有__种能量不同的电子。
(2)R的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是__。
(3)ZM3-空间构型为___,其中Z的杂化方式为__。
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为___;与YM分子互为等电子体的离子的化学式为___。
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为___,A、B中W原子的配位数之比为___。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为___。
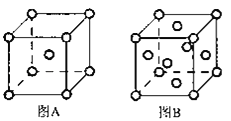
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛的用途,请根据周期表中短周期元素相关知识回答下列问题:
(1)空气中含量最高的元素与第三周期非金属性最强的元素形成的化合物的电子式: ___;
(2)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____;
a.NH3 b.HI c.SO2 d.CO2
(3)第三周期金属性最强和非金属性最强元素形成的化合物的水溶液通电条件下发生的离子反应方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.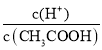 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是________。
(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,醋酸的电离平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________mol·L-1(用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)变为b mol·L-1,则此时c2(H+)=________(用含a、b的代数式表示)mol·L-1。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
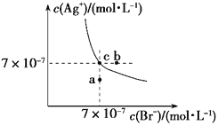
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O72-废水( pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中 D 和 E 为阳离子交换膜或阴离子交换膜,Z 为 待淡化食盐水。已知 Cr3+ 完全沉淀所需的 pH 为 5.6。下列说法不正确的是
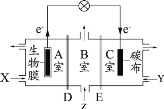
A.C室的电极反应式为 ![]() +6e+8H+=2Cr(OH)3 ↓ + H2O
+6e+8H+=2Cr(OH)3 ↓ + H2O
B.X为有机物污水,Y为含![]() 废水
废水
C.理论上处理 1mol![]() 废水的同时可脱除 6mol的NaCl
废水的同时可脱除 6mol的NaCl
D.E为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.C的非金属性强于Si,CH4的沸点高于SiH4
B.![]() 与
与![]() 得电子能力相同
得电子能力相同
C.短周期元素中原子半径最大的为Na
D.同族元素的原子化学性质相似,同族元素原子间可能形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com