
分析 (1)引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物,酸雨的危害很大,可以腐蚀建筑物、导致树木枯萎、影响农作物生长、使水体酸化等;
(2)CO和NOx在催化剂的条件下反应生成参与大气循环的无毒气体应为CO2和N2;
(3)二氧化硫和二氧化氮发生生成两种氧化物,二氧化硫具有还原性、二氧化氮具有氧化性,则二者发生氧化还原反应生成硫酸和NO;
(4)根据氧化还原反应中化合价升降相等以及电荷守恒、质量守恒来解答;
(5)根据氧化还原反应原理可知,反应后为NaNO2、NaNO3混合溶液.
解答 解:(1)SO2气体在空气中经粉尘催化氧化为SO3,SO3与水反应能生成硫酸,氮的氧化物和水反应生成硝酸,大气污染物中SO2、氮氧化合物是形成酸雨的主要气体,酸雨给人类和环境带来的危害有:腐蚀建筑物、酸化土壤、污染水体等,
故答案为:腐蚀建筑物、酸化土壤;
(2)CO和NOx在催化剂的条件下反应生成参与大气循环的无毒气体应为CO2和N2,反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2;
(3)二氧化硫和二氧化氮发生生成两种氧化物,二氧化硫具有还原性、二氧化氮具有氧化性,则二者发生氧化还原反应:NO2+SO2+H2O=NO+2H++SO42-,
故答案为:NO2+SO2+H2O=NO+2H++SO42-;
(4)反应SO2+ClO3---SO42-+ClO2,SO2中硫由+4价升高到+6价,ClO3-中Cl的化合价从+5价降低到+4价,由电荷守恒、质量守恒得:SO2+2ClO3---SO42-+2ClO2,
故答案为:2、1、2、1;
(5)NO2 和NO混合气体恰好被含0.8molNaOH的溶液吸收,发生反应:NO2+NO+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO2+NaNO3+H2O,所以另一种盐的化学式为NaNO2,
故答案为:NaNO2.
点评 本题考查了元素化合物知识,掌握硫和氮的化合物的性质是解答关键,侧重氧化还原知识原理的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白过的草帽日久会变色 | |
| B. | 用天燃气代替煤作燃料可减少大气污 | |
| C. | “84消毒液”杀死病菌是因为蛋白质变性 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A. | 含0.5 mol HCl的稀溶液与含 0.55 mol NaOH的稀溶液混合 | 测得放出热量为a kJ | 强酸与强碱反应的中和热为2a kJ/mol |
| B. | 向CuCl2、MgCl2的混合溶液中滴加NaOH溶液 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C. | 将铁钉和铜丝用导线连接后放入滴有酚酞的氯化铵溶液中 | 铜丝附近溶液变红色 | 铁发生吸氧腐蚀 |
| D. | 向某未知溶液中滴加酸性KMnO4溶液 | KMnO4溶液褪色 | 溶液中有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
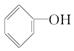 B.
B.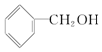 C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH
C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH查看答案和解析>>
科目:高中化学 来源: 题型:实验题
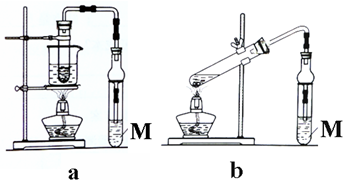
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
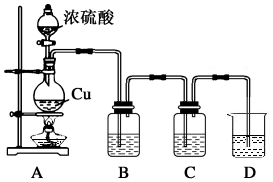
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com