
 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
分析 Ⅰ、脱硝:已知:H2的热值为142.9KJ•g-1,燃烧热为285.8KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g);
Ⅱ.(1)依据盖斯定律计算可以计算要求反应的焓变,再根据热化学方程式的书写方法得到热化学方程式即可;
该燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,电解质为熔融碳酸钾,负极上CO失电子和碳酸根离子反应生成二氧化碳
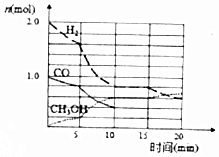
(2)图象中氢气变化物质的量2.0mol-0.8mol=1.2mol,氢气反应速率v=$\frac{△c}{△t}$=,反应为CO(g)+2H2(g)?CH3OH(g),反应的一氧化碳物质的量0.6mol,转化率=$\frac{消耗量}{起始量}$×100%;
(3)①平衡标志是正逆反应速率相同,个组分含量保持不变,原则是变量不变分析选项;
②利用三段式,根据等效平衡的思想可答题设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a b b;
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g),计算浓度商和平衡常数比较判断此反应速率的关系.
解答 解:Ⅰ. 已知:H2的热值为142.9KJ•g-1,燃烧热为285.8KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1;
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1;
Ⅱ.脱碳:(1)该燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,电解质为熔融碳酸钾,负极上CO失电子和碳酸根离子反应生成二氧化碳,电极反应式为CO-2e-+CO32-=2CO2,
故答案为:CO-2e-+CO32-=2CO2;
(2)图象中氢气变化物质的量2.0mol-0.8mol=1.2mol,10分钟大多平衡状态,氢气反应速率v=$\frac{△c}{△t}$=$\frac{\frac{1.2mol}{VL}}{10min}$=$\frac{0.12}{V}$mol/(L•min),反应为CO(g)+2H2(g)?CH3OH(g),反应的一氧化碳物质的量0.6mol,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.6mol}{1mol}$×100%=60%,
故答案为:$\frac{0.12}{V}$mol ( L•min );60%;
(3)①发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
a、反应前后气体物质的量变化,气体质量不变,混合气体的平均式量始终保持不变,能说明反应达到平衡状态,故a正确;
b、CO2和H2的体积分数保持不变是平衡标志,故b正确;
c、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;
d、反应前后气体质量和体积不变,混合气体的密度保持不变,不能说明反应达到平衡状态,故d错误;
e、1mol CO2生成的同时有3mol H-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故e正确;
故答案为:a b e;
②设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a b b
则由题意可知:$\frac{x+x+1-x+3-3x}{1+3}$=0.6,
解得x=0.8,
平衡常数K=$\frac{0.8×0.8}{0.2×(3-2.4)^{3}}$=14.8,
根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+b=1,要使反应始终向逆向进行,则b>x,故a的范围为小于等于1大于0.8,
0.8<b≤1,故选b,
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g),Qc=$\frac{0.5×0.5}{0.5×0.{5}^{3}}$=4<K,则此反应速率的关系v正>v逆.
故答案为:b;>.
点评 本题主要考查了热化学方程式的书写、电极反应的书写、化学平衡的计算及氧化还原反应方程式的书写,综合性较强,题目难度中等.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C6H14且含有三个甲基 | 2 |
| B | 分子式为C5H10,不能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,不能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2能与NaHCO3反应产生气体 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中无碳碳双键,苯不能发生加成反应 | |
| B. | 甲烷能与氯水发生取代反应 | |
| C. | 乙醇在一定条件下能被氧化成乙醛 | |
| D. | 乙烯和苯均能与溴水反应而使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
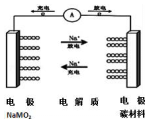 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
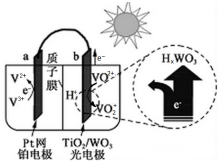
| A. | 光照时,太阳能主要转化为电能 | |
| B. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| C. | 光照时,每转移5 mol电子,有5mol H+由b极区向a极区迁移 | |
| D. | 夜间,a极的电极反应式为V3++e-═V2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
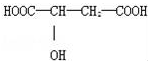 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生消去反应 | |
| D. | 苹果酸不能发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |   |  |
| 有效成分 | NaCl | Na2CO3 | Al(OH)3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做发酵粉 | 做抗酸药 | 做消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
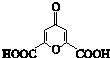 白屈菜有止痛、止咳功效,从其中提取的白屈菜酸的结构简式如图所示,下列有关白屈菜酸(R)的说法中,正确的是( )
白屈菜有止痛、止咳功效,从其中提取的白屈菜酸的结构简式如图所示,下列有关白屈菜酸(R)的说法中,正确的是( )| A. | R能发生氧化、加成、取代反应 | B. | R分子含1个苯环,属于芳香化合物 | ||
| C. | 常温下能与乙醇发生酯化反应 | D. | 1molR与足量钠反应生成2molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 维生素是人体需要的营养物质.图为某品牌维生素C泡腾片说明书的部分内容.该泡腾片中添加的着色剂是喹啉黄,甜味剂是糖精钠.泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和碳酸氢钠反应释放出了气体.
维生素是人体需要的营养物质.图为某品牌维生素C泡腾片说明书的部分内容.该泡腾片中添加的着色剂是喹啉黄,甜味剂是糖精钠.泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和碳酸氢钠反应释放出了气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com