
| A. | 石墨转化为金刚石 | B. | NaCl晶体熔化 | ||
| C. | 干冰升华 | D. | HCl溶于水 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ② | C. | ③和④ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
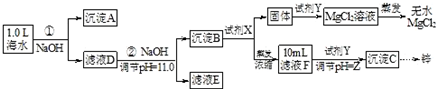
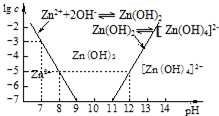
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
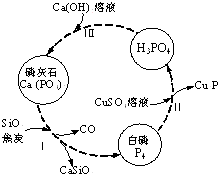 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 12g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
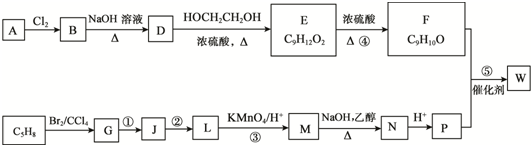
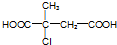 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.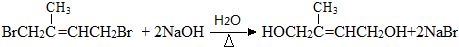 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com