
分析 (1)Al3+、Fe3+水解形成胶体,胶体具有吸附性;
(2)根据化合物中各元素化合价的代数和为0确定这几个字母之间的关系;
(3)①搅拌可以是反应物混合均匀;
②根据消耗的盐酸计算n(OH-),根据与BaCl2反应沉淀的沉淀的质量求出n(SO42-),根据与碘离子反应的关系求出n(Fe3+),根据电荷守恒计算n(Al3+),再根据总质量求出水的质量及物质的量,根据物质的量之比确定化学式.
解答 解:(1)聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O]在水中能够电离出Al3+、Fe3+,Al3+、Fe3+水解形成胶体,胶体具有吸附性,能够吸附水中的悬浮颗粒,从而起到净水的作用;
故答案为:聚合硫酸铝铁溶于水电离的Al3+、Fe3+可以水解形成胶体,具有吸附性;
(2)AlaFeb(OH)m(SO4)n•xH2O中中各元素化合价的代数和为0,所以3a+3b+(-1)×m+(-2)×2=0,所以得3a+3b=m+2n,
故答案为:3a+3b=m+2n;
(3)①搅拌可以是反应物混合均匀,有利于反应物充分接触,使反应物完全反应;
故答案为:混匀反应物,确保反应完全;
②n(OH-)=2n(H2SO4)=0.15L×0.100 mol•L-1×2=0.03mol,
n(SO42-)=n(BaSO4)-n(H2SO4)=$\frac{10.4850g}{233g•mo{l}^{-1}}$-0.15L×0.100 mol•L-1=0.03mol,
已知:I2+2Na2S2O3=2NaI+Na2S4O6,2Fe3++2I-=2Fe2++I2,则2Fe3+~I2~2Na2S2O3,
n(Fe3+)=n(Na2S2O3)=0.02L×0.500 mol•L-1=0.01mol,
在AlaFeb(OH)m(SO4)n中离子所带电荷守恒,
则n(Al3+)=$\frac{1}{3}$×(0.03mol+0.03mol×2-0.01mol×3)=0.02mol
8.810g样品中水的质量:m(H2O)=8.810g-0.02mol×27g•mol-1-0.01mol×56 g•mol-1-0.03mol×17 g•mol-1-0.03mol×96 g•mol-1=4.32 g,
则n(H2O)=$\frac{4.32g}{18g/mol}$=0.24mol,
所以n(Al3+):n(Fe3+):n(OH-):n(SO42-):n(H2O)=2:1:3:3:24
则硫酸铝铁的化学式为:Al2Fe(OH)3(SO4)3•24H2O;
答:聚合硫酸铝铁的化学式为Al2Fe(OH)3(SO4)3•24H2O.
点评 本题考查了探究物质的组成、胶体的性质、化合物中化合价的关系等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握物质化学式的确定方法.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键角是确定多原子分子立体结构(分子形状)的重要参数 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 共价键的键长越长,键能则越小,共价化合物也就越稳定 | |
| D. | 同种原子间形成的共价键键长:叁键<双键<单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+ )>c(H+)>c(OH-) | B. | c(B+ )+c(H+ )=c(A-)+c(OH-) | ||
| C. | c(B+ )>c(A-)>c(H+ )=c(OH-) | D. | c(BOH)+c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: ,其中心原子N的杂化方式是sp3.
,其中心原子N的杂化方式是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
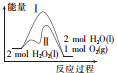
| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ | |
| D. | 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3 | |
| B. | 用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性 | |
| C. | 用反应热数据的大小,可判断不同反应的反应速率的快慢 | |
| D. | 用原子半径数据,可推断某些原子氧化性或还原性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
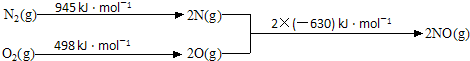

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | GFP可以溶于水,且其水溶液可以通过滤纸 | |
| B. | 为了防止GFP变质,可以培养在福尔马林溶液中 | |
| C. | GFP在一定条件下会发生水解,且水解产物一定只有α-氨基酸 | |
| D. | 灼烧GFP会产生烧焦羽毛的气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com