
| A.①和② | B.②和③ | C.①和③ | D.只有② |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.用分液漏斗分离乙酸乙酯和水、酒精和水 |
| B.苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化 |
| C.苯酚俗名石炭酸,向苯酚稀溶液中滴入石蕊试液变浅红色 |
| D.苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.做焰色反应实验时,火焰的颜色呈黄色,说明有钠元素存在 |
| B.欲除去Cl2中混有的HCl,最好是通过饱和石灰水 |
| C.欲除去CO中混有的CO2,可让混合气体通过Na202固体 |
| D.CO2溶于水能导电,因此CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. 测定中和反应的反应热 |
B. 配制100mL 0.1mol/L盐酸 |
C.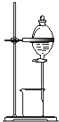 用来分离乙醇和水 |
D. 实验室制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
| ||
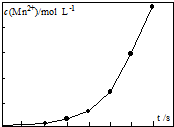
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ||
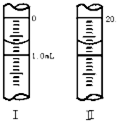
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com