
下列过程或现象与盐类水解无关的是( )
|
| A. | 热的Na2CO3溶液可以除去油污 |
|
| B. | ZnCl2和NH4Cl溶液可作金属焊接中的除锈剂 |
|
| C. | 用食醋除水垢 |
|
| D. | 将AlCl3溶液加热蒸干、灼烧,最后得到的固体时Al2O3 |
考点:
盐类水解的应用.
专题:
盐类的水解专题.
分析:
A、碳酸根离子水解显碱性,是吸热过程;
B、两种都是强酸弱酸盐,水解后显酸性,能与铁锈反应,所以可作除锈剂;
C、食醋主要成分为醋酸,醋酸酸性强于碳酸;
D、铝离子水解生成氢氧化铝和盐酸,加热蒸发,氯化氢挥发促进水解进行彻底;
解答:
解:A、碳酸根离子水解显碱性,CO32﹣+H2O⇌HCO3﹣+OH﹣,是吸热过程,加热促进水解,氢氧根离子浓度增大,减小增强有利于油脂水解;所以热的Na2CO3溶液可以除去油污,故A有关;
B、ZnCl2和NH4Cl溶液都是强酸弱碱盐水解显酸性,与铁锈反应,所以可作除锈剂,故B有关;
C、醋酸和碳酸钙反应生成醋酸钙和二氧化碳,发生的是复分解反应,故C无关;
D、铝离子水解生成氢氧化铝和盐酸,加热蒸发,氯化氢挥发促进水解进行彻底,生成氢氧化铝沉淀,灼烧,最后得到的固体时Al2O3,和水解有关,故D有关;
故选C.
点评:
题目考查盐类水解的应用,理解盐类水解实质是关键,题目较简单.


科目:高中化学 来源: 题型:
在CH3COOH⇌H++CH3COO﹣的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取措施是( )
|
| A. | 加入NaOH | B. | 加入盐酸 | C. | 加水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
|
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )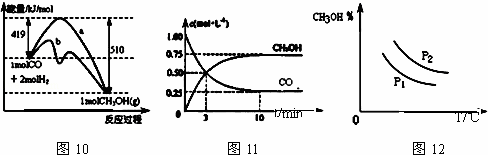
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有pH=12的NaOH溶液100mL.如果将其pH降为11,那么:(忽略混合时溶液体积的变化)
(1)若用蒸馏水应加入 mL
(2)若用pH=10的NaOH溶液应加入 mL
(3)若用pH=2的盐酸溶液应加入 mL
(4)若用0.01mol∙L﹣1的醋酸应加入的范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
|
| A. | HX、HZ、HY | B. | HZ、HY、HX | C. | HX、HY、HZ | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②常温下pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Al3+、Cl﹣、S2﹣
⑥使pH试纸呈红色的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
|
| A. | ②④ | B. | ③⑤ | C. | ④⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)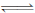 CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
①该反应能否自发进行与___________有关。
②一定温度下,在一个容积可变的密闭容器中, 发生上述反应,下列能判断该反应达到化学平衡状态的是___________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O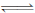 CO2(g)+H2 (g),得到如下三组数据:
CO2(g)+H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为__________(填”吸”或”放”)热反应。
③若使实验3达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min, 则a、b应满足的关系是______________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)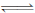 CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,有关弱酸的电离常数如下表,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10﹣5 | 4.9×10﹣10 | K1:4.3×10﹣7 K2:5.6×10﹣11 |
|
| A. | 相等物质的量浓度溶液pH关系:pH (NaCN)>pH (Na2CO3)>pH (CH3COONa) |
|
| B. | 相等物质的量浓度的HCN和NaCN混合溶液中:c (HCN)+c(H+)=c (OH﹣)+c (CN﹣) |
|
| C. | a mol/LHCN与b mol/LNaOH溶液等体积混合后所得的溶液中:若c(Na+)>c (CN﹣),则a一定小于b |
|
| D. | 将Na2CO3加入到HCN溶液中时发生如下反应:Na2CO3+HCN=NaCN+NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com