
已知在一定条件下2SO2(g)+O2(g)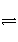
 2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2 B.Q1>Q2>Q C.Q1>Q>Q2 D.Q1=Q2>Q
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+
④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金
A.①③④ B.②③④⑤ C.①③④⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:(1)2A(g)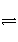
 2B(g)+C(g);(2)A(g)
2B(g)+C(g);(2)A(g)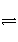
 C(g)+D(g)。当达到平衡时,测得[A]=2.5 mol·L-1,[C]=2.0 mol·L-1。则下列说法中正确的是( )
C(g)+D(g)。当达到平衡时,测得[A]=2.5 mol·L-1,[C]=2.0 mol·L-1。则下列说法中正确的是( )
A.达到平衡时A的总转化率为40%
B.达到平衡时[B]为1.0 mol·L-1
C.达到平衡时[B]=2[D]
D.达到平衡时[D]=2[B]
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在800 K时,反应:CO(g)+H2O(g)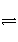
 H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知弱酸的电离平衡常数如下表,下列选项正确的是( )
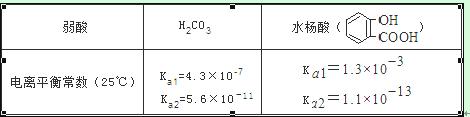
A.常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3 溶液和 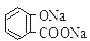 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.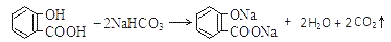
D.水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
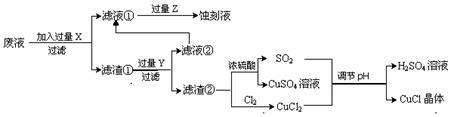
|
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是_____________________。
(2)写出生产过程中X:____ ______ Y:_____ _____ (填化学式)。
(3)写出产生CuCl的化学方程式:_________________________________________。
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是:______________________________。
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
________________________________ _____。
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源: 题型:
橄榄石型LiFePO4是以中国锂离子电池正极材料,下列有关LiFePO4的说法中不正确的是
A. LiFePO4中铁元素的化合价为+2价
B. LiFePO4中Li、P、O均属于短周期元素
C. 能与稀硝酸发生氧化还原反应
D. LiFePO4中Li、Fe、P均属于主族元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com