
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A、若a=b,则c(NH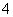 )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH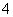 )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D. (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且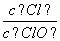 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后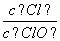 =11,则溶液中
=11,则溶液中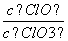 =
=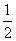
B.参加反应的氯气的物质的量等于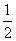 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: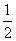 a mol≤ne≤
a mol≤ne≤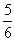 a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为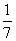 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65 mL 0.020 mol·L-1的酸性KMnO4溶液完全作用,则在上述反应中,羟胺的氧化产物是[已知:FeSO4+KMnO4+H2SO4—→Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平)]( )
A.N2 B.N2O C.NO D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.催化转化机动车尾气为无害气体,能消除酸雨 和雾霾的发生
和雾霾的发生
C.研发高效低毒的农药,降低 蔬菜的农药残留量
蔬菜的农药残留量
D.积极开发废电池的综合利用技术,防止电池中的重金属等污染土壤和水体
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如右图:
反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成正丁醚的步骤:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为______________________________。
写出步骤②中制备正丁醚的化学方程式______________________________。
(2)加热A前,需先从__________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应从分液漏斗的  (填“上”或“下”)口分离出。
(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为______________________________。
(5)步骤⑤中,加热蒸馏时应收集__________(填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为__________,下层液体的主要成分为__________。(填物质名称)
(7)本实验中,正丁醚的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com